|
|
|
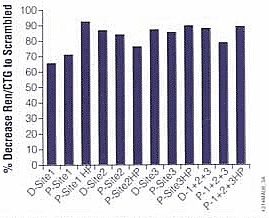
图4:比较用化学合成的或用T7 RiboMAXTM Express RNAi 系统提外合成的三种不同的海肾siRNA对海肾荧光素酶表达的抑制程度。将针对hRluc mRNA三个不同位点的siRNA各20ng转染稳定表达优化密码子的海肾荧光素酶基因(hRluc)的CHO细胞。另外,对相同3个位点的体外合成的shRNA也进行检测。用一种“杂乱”siRNA作为阴性对照,用化学合成的siRNA作为阳性对照(Dharmacon)。采用siLentGeneTM Transfection Reagent在96孔板中进行转染,每种siRNA转染8个复孔。转染后24小时,4个孔用海肾荧光素酶分析系统分析hRluc的活性,4个孔用CellTiter-Glo® 发光细胞生存分析系统检测细胞的数目。对每种siRNA的转染,计算平均hRluc信号与平均CellTiter-Glo® 信号的比值,并计算该比值与阴性对照组该比值的差值。图中显示的数据是与“杂乱”siRNA的转染相比,海肾hRluc信号/CellTiter-Glo® 分析信号之比值下降的百分比。D=从Dharmacon化学合成的siRNA;P=用T7 RiboMAX(tm) Express RNAi 系统体外转录的siRNA;HP=用T7 RiboMAXTM Express RNAi 系统体外转录的shRNA。所有体外合成的siRNA和shRNA用技术手册TB316介绍的技术进行合成和纯化,并在2.5%琼脂糖/1×TAE凝胶上进行定量,用已知量的化学合成的siRNA作为对照。电泳后凝胶用1:10,000 SYBR(r) Green Ⅱ(Molecular Probes)染色20分钟,而后用Molecular Dynamics Storm(r)荧光扫描仪进行扫描定量(blue mode; PMT=1,000) 结 论T7 RiboMAXTM Express RNAi 系统可快速、有效合成siRNAs或shRNAs,从而进行哺乳动物RNA干扰的研究。一般是每毫升反应体系可产生1-2mg siRNA或shRNA。该系统的唯一要求是用包含目的序列的dsDNA为模板。体外合成方法简单,可对单一靶点产生多种siRNA,从而可快速合成和筛选对靶蛋白高度抑制的siRNA。
|
|