用多维液相色谱(MDLC )MS/MS方法进行宽动态范围的人血浆蛋白质组学的研究
Axelman, J.§, Goscinski, J.§, Fenyo, D.§, Lindqvist, S.§, Berg, M.^, Parbel, A.^, Jonsson, A.§
GE Healthcare, Discovery Systems, Amersham Biosciences, §Sweden, ^Germany
|
简介
筛选生物标记物在蛋白质组学中是一个很有前景的应用。MDLC工作流程非常适合于处理大量组分,并从这些极度复杂和宽动态范围的样本中识别和鉴定低丰度蛋白质。
本研究比较了用不同亲合策略去除高丰度蛋白的方法流程,并以实例论证了这些分析方法的分离能力和动态范围。 |
|
|
摘要
通过一整套完全去除高丰度蛋白的方法鉴定了316个蛋白质,其中的187个蛋白,每个都至少有两个以上的肽段被鉴定,例如:血浆蛋白质:Apolipoprotein A-IV (29), a-1-antitrypsin (34);局部受体配体:Lumican (6);长距离受体配体:Adiponectin (1);组织渗漏蛋白:Actin, aortic smooth muscle (4), Cadherin-13 (2), Polycystic kidney disease 1-related protein (1), Myosin heavy chain (1);潜在生物标记物:Tumor endothelial marker 7-R (2)。(括弧中的数字表示被鉴定出的肽的数目)
使用HiTrap™ Blue层析柱和HiTrap™ Protein G层析柱进行预分离,整个实验过程,包括所有步骤中的动态范围估计可达到106-107个数量级。 |
|
方法
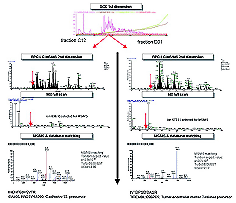
用MDLC-MS/MS流程来分析人血浆样品,尽可能多地鉴定样本中的蛋白质。采用Ettan™多维液相色谱系统(通用电气医疗集团(原安玛西亚公司)),在亲合去除的这一步,使用了三种不同的流程(图3):全血浆酶解产物直接用来做MDLC分析(工作流程[1]); 使用HiTrap™ ProteinG 去除IgG(工作流程[2]);先后使用HiTrap™ Blue (去除白蛋白)和HiTrap™ ProteinG柱(工作流程[3])。所有的过程中,还原烷基化后的样本都用Ettan™ Trypsin (测序级)胰蛋白酶酶切,反应条件为在50mM NH4HCO3 (pH 8.4)中37℃孵化12小时。LC的工作流程是从肽水平起始的(图1),三种情况下,都是在2.1 mm BioBasic(r) 阳离子交换柱(ThermoHypersil)上样1mg,第一维的流速是200 ml/min ,每100ml收集一次组分,共收集50个组分准备进一步分析,片断的浓缩去乙腈通过一步旋转真空干燥来完成,随后50个组分用同一色谱系统的高通量纳升级液相色谱分离这一设置进行分析。洗脱出的肽段用Thermo Finnigan LTQ™ 离子阱质谱进行MS/MS分析,采用方法分两步:先是进行全扫描,然后是5个MS/MS谱图的扫描。 |
|
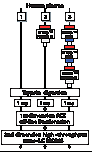
图3 三种平行的工作流程 |
|
结果和讨论
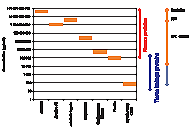
鉴定的蛋白质数量 使用工作流程[图3]鉴定了316种蛋白质(可信度域值0.05),可信度最高的候选蛋白质大都是序列覆盖率很高的标准血浆蛋白质,最多有58个肽被鉴定为同一蛋白。至少15个蛋白质可被归类为组织渗漏蛋白,揭示了该方法在动态范围上的潜力(图2)。部分被鉴定的蛋白质是被研究过的生物标记物(如 Davies 等,2004, Huang 等,2004)。类似于早期的研究,相当多被鉴定出来的肽段都已被增录到数据库中并被标明为假定蛋白质(如 Anderson 等, 2004)。
动态范围 第一维的阳离子交换将样本分离成了50个组分(图3),这样就把样本的动态范围大约降低了1-2个数量级。通过分析标准蛋白的酶解产物估计第二维的反相RPC-MS/MS分析的动态范围在104-105个数量级。结合两者,MDLC-LTQ方法的动态范围估计有106-107。一些试验中甚至可以观察到在此动态范围外的低丰度蛋白质。
 |
|
图2 部分经鉴定蛋白浆浓度,右边的经色和蓝色条分别表示预期的血浆和组织渗漏蛋白的浓度范围,这是蛋白质鉴定中最主要的两类.相关数据来自Anderson和Ander-son(2002),Brock(1990), Huang等人(2004)及Onuoha(1999). |
|
|
 |
|
图1 去除白蛋白和IgG后的复杂样本中低丰度蛋白的鉴定 |
亲合去除单元 通过工作流程[图3]最大程度地降低了样本的动态范围。选用亲合层析柱有效地去除了白蛋白和IgG(SDS-PAGE结果略)。这个单元使得样本的动态范围降低了3倍,而流程[2]仅能降低1.2倍。第一维阳离子交换柱的上样量为1 mg,这样流程[3]相对于流程[2]和流程[1]血浆量的上样体积更大。由于LTQ离子阱质谱可以足够快的在30秒内将白蛋白中胰蛋白酶酶切的肽全部测序,因此对于样本复杂性降低的要求并不十分重要。工作流程[1]和[2]中白蛋白的肽都属于样本中的高丰度组分,在鉴定的数量上没有显著差异。尽管工作流程[3]的动态范围明显好于流程[1],可由于一些蛋白可能结合在高丰度蛋白上,导致其在清洗的过程中丢失。
|
|
参考文献
Anderson N.L., Anderson N.G. (2002) Mol Cell Proteomics Vol 1, p 845-867.
Anderson et al. (2004) Mol Cell Proteomics Vol 3, p 311-326.
Brock A. (1990) J Clin Chem Clin Biochem Vol. 28, p 851-856.
Craig R., Beavis R.C. (2003) Rapid Commun Mass Spectrom Vol. 17, p 2310-2316. |
|
Davies et al. (2004) Clin Exp Metastasis 21, p 31-37.
Huang K.C. et al. (2004) Obes Res Vol. 12, p 119-124.
Liotta, L.A. et al. (2003) Clinical proteomics: written in blood. Nature 425, 905
Onuoha G. et al. (1999) Clin Invest Med Vol. 22, p 180-184. |
|
|
| |
|