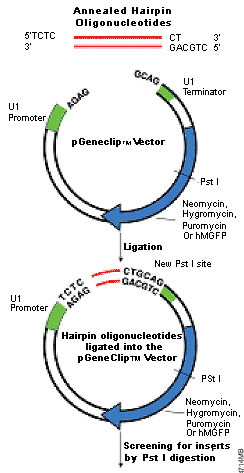
图 2. GeneClip™ U1 Hairpin Cloning System 操作步骤概述
用了若干参数,包括检查反义序列5'末端的自由能,评估siRNA候选目标位点等。虽然siRNA Designer 可选择有效的潜在siRNA序列,但是不能保证选中序列都将会高度有效。还必须进行实验测试最佳序列,以确保实现高度抑制作用。psiCHECK™ 载体 (Cat.# C8011,C8021),能够监测与报告基因融合的待研究的基因序列表达的变化,从而提供一个有用的筛选工具,实现快速测试siRNA序列抑制目标基因表达的效率(5)。
发卡克隆
一旦选定了目标位置,将合成的发卡寡核苷酸退火并插入pGeneClip™ 载体,然后筛选克隆质粒(图2)。这两个寡核苷酸形成的DNA插入物包含一个发卡siRNA目标序列。寡核苷酸的常规脱盐处理是必需的,但是凝胶纯化和5'磷酸化过程却不是必需的。因为插入载体的寡核苷酸很短(~60nt),常规琼脂糖凝胶电泳识别可能很困难。为了使插入物的识别变得更为方便,在载体骨架中设计了一个Pst I酶切位点(图2)。在退火的寡核苷酸成功插入载体后,会形成第二个Pst I位点。用Pst I消化后,可产生两个容易分离的、大小分别约为3 kb和1 kb的DNA条带。如果没有插入物存在,Pst I消化后将会形成一个单一带。在我们所做的实验中,含有寡核苷酸插入片断的克隆菌数目比载体自连的克隆菌数目高50多倍。此外,Pst I消化显示超过90%的菌落包含插入物。
|
|
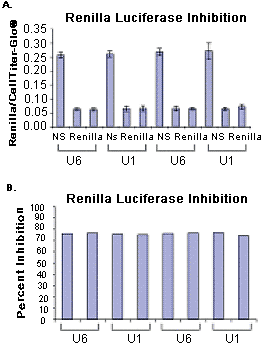
图3. 以U1为基础的pGeneClip™ 和以U6为基础的psiSTRIKE™ Basic载体的海肾(Renilla)萤光素酶的瞬时抑制效果。pGeneClip™ 和psiSTRIKE™ Basic 载体包含非特异性shRNA(NS)或海肾(Renilla)萤光素酶-特异的shRNA,被转染进HeLa细胞,以稳定地表达海肾(Renilla)萤光素酶。每个载体系统独立进行转染。在转染48小时后,EnduRen™ 活细胞底物(Cat.# E6482)被添加到反应体系中,以测定海肾(Renilla)萤光素酶的活性。用CellTiter-Glo® 试剂(Cat.# G7571)测定细胞活力。图A,将海肾(Renilla)萤光素酶活性相对于细胞活力进行归一化。图B,以海肾(Renilla)萤光素酶特异的shRNA转染组的发光强度除以非特异性对照组的发光强度,得出抑制率。
瞬时抑制作用
在瞬时抑制分析中,我们比较了siSTRIKE™ U6 Hairpin Cloning System (以U6 启动子(6)为基础)与GeneClip™系统的效果。同样的能干扰海肾(Renilla)表达的shRNA目标序列被克隆到 pGeneClip? 和 psiSTRIKE™ -Basic载体,并转染能稳定表达海肾(Renilla)萤光素酶的HeLa细胞系(图3),结果观察到的抑制水平相似。在多次重复实验中, 基于U1 和 U6的系统对海肾(Renilla)萤光素酶的抑制水平都超过了70%。这些结果表明,在siRNA实验中,U1启动子与U6启动子的功效相当。
我们在几种类型的细胞中测试了 pGeneClip™ -Basic载体,以确定在这些细胞系中U1是否具有DNA介导的RNAi活性。将可同时表达海肾(Renilla)和萤火虫萤光素酶活性的psiCHECK™-2载体与pGeneClip™- Baisc 载体共转染,该载体编码有海肾(Renilla)萤光素酶的干扰shRNA或非特异性对照序列。由U1启动子表达的shRNA可以抑制海肾(Renilla)萤光素酶在多种不同细胞系中表达,包括HeLa,293T,PC3,K562,HCTll6和HEC 592 |