通常,大规模纯化用于结构或功能研究的组氨酸标记蛋白均使用柱分离方法,采用分离柱来纯化蛋白需要几个小时的时间。MagneHisTM蛋白纯化系统可在不到30分钟的时间内从1L培养体系中纯化出蛋白。图5显示了MagneHisTM系统既可用于小规模纯化,又可用于大规模纯化。
|
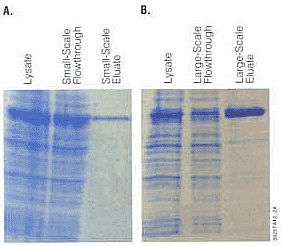
图5. 小规模纯化与大规模纯化。将100ml 表达有组氨酸标记的甲基化tRNA合成酶的培养物离心,6000rpm,15分钟。去除上清,将沉淀的细胞团冻存于-70℃。用10ml
MagneHisTM 细胞裂解试剂将细胞团重悬,室温震荡孵育10分小规模:该纯化步骤依照图2所描述的进行:将100μl上清液加入30μl
MagneHisTM 镊颗粒中。
大规模:将8ml裂解物加入装有24ml
MagneHisTM
镊颗粒的锥形管中,室温下颠倒钟。该上清液用于比较组氨酸标记蛋白的小规模和大规模纯化效果。
混匀2分钟,然后将反应管置于磁力架上。倒出上清,储存成小份。MagneHisTM 镊颗粒用12ml 含100mM HEPES,10mM 咪唑[pH 7.5]的MagneHisTM
结合/洗涤缓冲液洗涤3次。用800μl
MagneHisTM 洗脱缓冲液(100mM HEPES,500mM 咪唑[pH 7.5])洗脱组氨酸标记蛋白。取样品200μl,用SDS-PAGE分析,以GelCode Blue显色。
MagneHisTM 细胞裂解试剂的优点
相对于耗时的溶菌酶裂解细胞的方法,MagneHisTM 细胞裂解试剂提供了一个快速而高效的替代方法。这个专利配方可使细胞内蛋白在10分钟内得到最大释放,从而使这一重要的孵育过程可被整合到各种高通量应用中。细胞裂解的程度可与优质的裂解试剂相媲美,图6A比较了用MagneHisTM 细胞裂解缓冲液和其它2个类似产品裂解细胞、释放总蛋白的结果。MagneHisTM 细胞裂解试剂还有另外一个优点:潜在地促进蛋白结构的稳定性,因而可保持较高水平的酶活性。这一点已用裂解表达萤火虫荧光素酶的克隆来证实(图6B)。该结构稳定效应在β-半乳糖苷酶和海肾荧光素酶中也观察到了。 |
|
|
图6. MagneHisTM 细胞裂解试剂与其他裂解试剂的比较。依照相应的操作说明,将表达用6个组氨酸标记的萤火虫荧光素酶的细胞分别用MagneHisTM 细胞裂解试剂、A及B裂解试剂进行裂解。用BCA方法检测裂解物中的蛋白浓度(图A)和荧光素活性(图B)。
组氨酸标记蛋白的自动化纯化
由于蛋白质组学的研究要求要有高通量的纯化产品,因此,人们越来越需要拥有配合自动化平台工作的操作方案。我们设计的MagneHisTM 蛋白纯化系统即可用于单个蛋白的手工纯化,又可用于不同的自动化平台。如需关于高通量应用的详细资料,请参阅Promega Notes 83期的其它文章(11)。
|
参考文献
1. Jung, H. et al. (2001) J. Biol. Chem. 276, 15504-10
2. Thess, A. et al. (2002) J. Biol. Chem. 277, 36321-8
3. Fodor, S.K. and Vogt, V.M. (2002) J. Virol.76, 4341-9
4. Lee, J.H., Voo K.S. and Skalnik, D.G. (2001) J. Biol. Chem. 276, 44669-76
5. Tian, B. and Mathews, M.B.(2001) J. Biol. Chem. 276, 9936-44
6. Wada, M. et al. (2002) J. Biochem. 131, 307-11
7. Sivaraman, J. et al. (2002) J. Biol. Chem. 277, 44214-9
8. Ko, T.P. et al. (2001) J. Biol. Chem. 276, 47474-82
9. Yip, T.T., Nakagawa, Y. and Porath, J. (1989) Anal. Biochem. 183, 159-71
10. Hutchens, T.W. and Yip, T.T. (1990) J. Chromatogr. 500, 531-42
11. Bjerke, M. et al. (2003) Promega Notes. 83, 6-9 |
|