把其洗脱下来。用C18 ZipTipTM脱盐后用5mg/ml SA基质溶解液洗脱下来并点样。等风干后进行质谱鉴定,取得理想的结果(图4)。
2.3 芯片表面结合特异性分析
BIA/MS的方法不但具有实时分析并定量两个蛋白相互作用的优点,它还具有一定的分离纯化的能力,能从细胞或组织提取液中分离与连接子特异相互作用的蛋白[2]。β 2-Microglobulin是血清中的一个重要的标志性蛋白,它的高低是检测许多疾病的指标之一。为了证明芯片结合的特异性和其分离功能,取人血清样品经HBS-EP稀释后流过芯片表面,然后再生并质谱分析其再生液。图5(A)是把血清样品稀释50倍后质谱分析图,从图上可以看出血清里含有许多蛋白成分,而b2-Microglobulin含量并不高。经过芯片的特殊相互作用分离后,洗脱产物所得到的质谱分析结果见图5(B)。从图中可以看到再生液中主要是微球蛋白,这说明BIA分析方法的非特异相互作用非常的弱,完全可以用于组织或者细胞样品的分析分离。BIA/MS方法这个优点非常有利于其在蛋白质组学研究中的广泛应用。
2.4 相互作用分子的酶解鉴定
对相互作用分子进行酶解鉴定,得到部分序列信息是BIA/MS的最大的优点,同时也是这个方法的关键之一。 实验时80nMβ 2-Microglobulin以2ul/min的流速进样30ul以便使连接子结合尽量多的蛋白,结合到芯片上后,用5ul的微量体积把感兴趣的蛋白洗下来(约10~50fmol)。把4次再生的样品收集在一起,大约3000RU(相当于约200fmol)的蛋白。用Trypsin酶解再生的蛋白。8h后终止酶解,用C18 ZipTipTM头 脱盐浓缩后用1.5ul的80%乙腈(含0.1%)洗脱下来,与1.5ul 4mg的HCCA基质混合用于质谱分析。
图6显示的是得到的PMF图。将其进行数据库搜寻得到明确的结果,表一列出了各片段匹配情况,整个蛋白序列匹配率高达50%,说明结果可靠,方法可行。
Table 1:数据库检索匹配的肽片段。 匹配的肽片段占完整蛋白的50%。
M/Z |
MH+ |
Delta |
Start |
End |
Peptide Sequence |
submitted |
mached |
ppm |
|
|
|
1122.6297 |
1122.6271 |
2.2743 |
93 |
102 |
(R)VNHVTLSQPK(I) |
2203.0233 |
2203.0276 |
-1.9349 |
70 |
86 |
(K)DWSFYLLYYTE
FTPTEK(D) |
2497.2084 |
2497.2073 |
0.4439 |
31 |
52 |
(K)SNFLNCYVSGFH
PSDIEVDLLK(N) |
2940.3573 |
2940.3078 |
16.8225 |
70 |
92 |
(K)DWSFYLLYYTEFT
PTEKDEYACR(V) |
|
|
3. 讨论(Discussion)
在BIACORE X的仪器上,我们描述了一个简单的,高灵敏度的鉴定与偶联在芯片上的连接子相互作用的蛋白的的方法——BIA/MS方法。它由偶联,相互作用,实时检测,微再生,酶解,MALDI-TOF MS分析和数据库搜寻鉴定等一系列方法构成,经过每一步优化处理, BIA/MS方法鉴定相互作用分子的灵敏度可以达到在fmol水平 [1,6]。
BIA/MS 与传统的方法相比,有许多优点,它不但可以定量测定两个蛋白间的相互作用,求出其动力学常数,还具有微分离纯化相互作用分子的作用,这对那些样品非常有限的样品非常有应用价值。样品的复杂性和低丰度的蛋白给蛋白组学的分析鉴定带来两个大的挑战,可以采用富集蛋白做进一步研究的策略。而与亲和色谱和免疫共沉淀等方法相比,使用BIA方法的SPR芯片技术作为微分离系统,,需要样品的量少得多。另外,简单的样品处理避免了样品的损失,这也非常有利于对那些丰度非常低的蛋白进行鉴定[1,7]。
参考文献
1. Frederic Lopez , et al, Proteomics[J], 2003,3,402-412
2. Jiro kikuchi, et al, Molecular Biotechnology[J], 2003,
Volume23, 203-212.
3. Dobrin Nedelkov, et al, Analytica Chimiica Acta[J],
423(2000)1-7.
4. Dobrin Nedelkov, et al, Proteomics[J], 2001, 1, 1441-
1446.
5. Sonksen,C,P., et, al, Anal. Chem[J],1998,70,2731-2736.
6. Dobrin Nedelkov, et al, Biosensors
Bioelectron[J],16(2001)1071-1078.
7. Thomas,et al, Electrophoresis[J], 2000,21,2252-2265.
 |
|
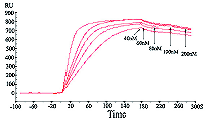
图1.重叠在一起的不同浓度的微球蛋白与鼠抗人微球蛋白相互作用的传感图.相互作用的动力学常数为Ka=2.76e5,Kd=1.21e-3。 |
 |
|
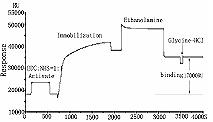
图2.通过氨基偶联的方法反抗微球蛋白的抗体偶联到传感芯片的传感图。 |
|