双向凝胶电泳中采用中等pH范围IPG胶条,
扩展了图谱,尤其在极端碱性区域
Ray Ismail*, Jan Goscinski*, Siham Cetinkaya, Kjell Larsson, Helena Nordvarg, Ingmar Olsson, Bengt Bjellqvist
GE Healthcare, Amersham Biosciences AB, SE-751 84 Sweden. |
|
引言
双向电泳技术是一种分辨率最高的蛋白分离技术。在一个实验中能分离几千个蛋白。然而要想找到低丰度蛋白或偏酸性/偏碱性蛋白时,一个宽范围固相pH梯度(immobilized pH gradient,IpG)胶条是不够的。需要采用更窄的pH梯度胶条,以提高分辨率和上样量。
为证明采用分开的扩展的pH范围胶条的优势,采用四个重叠的中等pH范围的IPG胶条,范围从pH3到pH11,用鼠肝样品进行微制务电泳。得到的双向电泳谱与宽范围的pH3-11 NL IPG胶条的相同区域比较蛋白点数。软件分析表明扩展的中等pH范围胶条的蛋白点数显著提高。
此外,碱性的pH7-11 NL IPG胶条得到很多在pH7-11 NL IPG胶条中没有显示的碱性蛋白。有的碱性蛋白用MALDI-TOF质谱分析鉴定。pH7-11 NL IPG胶条已经过化学修饰以提高蛋白上样量,并在保证重复性的前提下延长聚焦时间。 |
|
|
结论
● 采用重叠的中等pH范围胶条,扩展了pH范围,双向电泳图谱的分辨率显著提高
● 采用中等pH范围的IPG胶条,检测到的蛋白点数增加50-200%
● pH3-11 NL IPG胶条,给出宽范围的总览-中等pH范围胶条是微制备试验的理想选择
● pH7-11 NL IPG胶条的碱性端电泳稳定性提高,可鉴定碱性蛋白 |
图像分析
用ImageMasterTM 2D Platinum双向电泳分析软件分析图像,彩色框内的蛋白点进行计数后表明中等pH范围IP胶条的分辨率明显提高。检测到的蛋白点数在表1中显示。
|
|
结果:
扩展和重叠
来自宽范围pH 3-11NL IPG胶条和4个重叠的中等pH范围IPG胶条的双向电泳凝胶谱图。彩色框对应相同的pH间隔,在中等pH范围IP胶条进行扩展。圈出的蛋白点是胶条间重叠的部分。 |
|

|
图1。pH 3-11NL IPG胶条,采用阳极端杯上样200µg,聚焦45kvh。 |
|
|
分离碱性蛋白
pH 7-11NL IPG胶条稳定性提高(图7中显示pH梯度)。在碱性端分离玻一些在pH 3-11NL IPG胶条中(图6)丢失的蛋白。部分蛋白已用MALDI-TOF(表2)质谱分析鉴定。进一步分析鉴定该样品中更多的碱性蛋白的工作还在继续。然而,鉴定等电点接近11的蛋白,不仅与样品有关,也和样品制务有关。 |

图2.pH 3-5.6NL IPG胶条,采用泡涨上样500µg,聚焦65kvh。
|
图3.pH6.2-7.5NL IPG胶条,用纸桥法上样500µg,聚焦130kvh。
|
 |
 |
|
图6.蛋白上样200UG的pH3-11NL IPG 胶条的碱性端.蓝色虚线放在图5和图6的相同的pH位置。 |
|
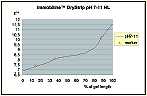
图7. pH7-11NL IPG胶条的计算的pH梯度曲线。 |
|
|
|
表2.pH7-11NL IPG胶条中已被鉴定的蛋白蛋白点号在胶中要注意出(图5) |
|
| |
材料和方法
样品制备
鼠肝组织在冰上超声,用含有20%TCA和0.2%DTT的丙酮溶液于-20℃沉演蛋白,然后在40000*g离心60分钟。沉淀重溶于含有0.2%
DTT的冰浴丙酮溶液中.离心后,沉演干后,溶解于
裂解缓冲液中(2M)硫脲,7M尿素,4%(W/V)CHAPS,1%(W/V)DTT,2%(V/V)
Pharmalyte 3-10mM蛋Quant kit)进行蛋白定量,
蛋白浓度为13mg/ml。
等电聚焦
所有的胶条用DeStreak™ 去除点拖尾泡涨液(DeStreak™ Rehydration Solution)进行泡涨。pH3-11NL IPG胶条上样200μg和500μg。pH3-5.6,5.3-6.5, 6.2-7.5和7-11NL IPG胶条
(Amersham Biosciences)上样500μg和800μg。 |
|
所有胶条用Ettan™ Manifold多功能件盒根据说明书在 Ettan IPGphor™ 一向等电聚焦电泳系统上运行(2)。
SDS-聚丙烯酰胺电泳
二向电泳前,两步平衡IPG胶条,每步15分钟,分别用DTT和碘乙酰胺,再在12.5% Laemmli 胶上进行二向电泳(3)。电泳后,蛋白用标准的胶体考马斯亮蓝方法染色,再用ImageScanner™ II扫描仪(安玛西亚公司)进行扫描。
图像分析和斑点处理
凝胶图像用ImageMaster 2D Platinum 5.0 双向电泳分析软伯进行分析。选取蛋白点用Ettan Spot Picker全自动斑点切取系统进行挖胶,再用Ettan Digester 全自动酶切系统进行胶内胰蛋白酶酶切,然后用Ettan Spotter全自动点靶系统将样品点在 MALDI-ToF质谱靶上。用Ettan MALDI-ToF Pro质谱进行蛋白鉴定。 |
|
|
|
参考文献:
1. A. Gorg, O. Drews and W. Weiss: Separa tion of proteins using two dimensional gel electrophoresis. In: Purifying Proteins for Proteomics: A laboratory Manual. (Ed R. E. Simpson),Cold Spring Harbour Laboratory Press,2004 (p. 391-430).
2. 2-D Electrophoresis Principles and Meth ods Ed. AB (Amersham Biosciences)
3. Laemmli, U.K. Nature 227 (p. 680-685), 1970.
|
|
|
|