DPPIV-Glo™检测方法显示出了比基于荧光的DPPIV 检测方法更高的灵敏度。研究人员使用较少量的酶依然可以得到满意的Z′值。 |
DPPIV-Glo? 蛋白酶检测原理
DPPIV-Glo™ 检测是一种测定 DPPIV 活性的均相生物发光检测方法。本检测系统中含有生物发光前体物质,Gly-Pro-氨基萤光素,作为DPPIV底物。该物质被加入到经过优化的、用于DPPIV及萤光素酶活性检测的缓冲液系统中。在这种均相的、双酶参与的反应中,只需要加入单一一种DPPIV-Glo™试剂就可以使 DPPIV 切割底物,同时激活萤光素酶反应,产生“辉光”型发光信号(图 1)。 DPPIV-Glo™ 试剂依赖于专利的热稳定萤光素酶(Ultra-Glo™ 重组萤光素酶)的独有特点,可以在较宽范围的检测条件下发出稳定的“辉光”型发光信号。
DPPIV-Glo™ 蛋白酶检测试剂盒的"加样-混合-检测"方式是为使用多孔板设计的,这也是它成为高通量筛选(HTS)的理想选择。这种双酶反应系统中, DPPIV 切割底物与萤光素酶消耗释放的氨基萤光素同时进行,导致
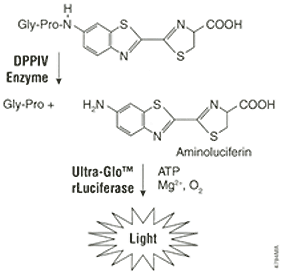
图1. 发光前体底物含有可以被 DPPIV 识别的 Gly-Pro 序列。DPPIV 切割后,萤光素酶的底物氨基萤光素被释放。引起萤光素酶反应并产生光信号。
发光信号与存在的DPPIV 活性成正比。本检测方法中,DPPIV 的浓度具有很宽的动态范围,从而大大地提高了灵敏度 (图2)。
比荧光检测更灵敏
我们比较了DPPIV-Glo™ 蛋白酶检测方法与荧光 DPPIV 检测方法,后者实验中相应的底物为Gly-Pro-