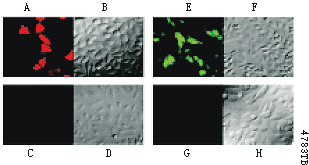
图6. 表达HaloTag™ 蛋白的固定细胞被HaloTag™ TMR或HaloTag™ diAcFAM配基所标记而得到的强荧光影像。A,B,E,F为瞬时转染了HaloTag™ pHT2载体的HeLa细胞,C,D,G,H为对照细胞。A到D为标记了5μM HaloTag™ TMR配基,E到H为标记了10μM HaloTag™ diAcFAM配基,操作参照图1的规程。细胞以3.7%的多聚甲醛固定,使用适当的TMR和FAM滤过或透光装置,在Olympus FV500共聚焦显微镜下获得以上影像(图B,D,F,H)。
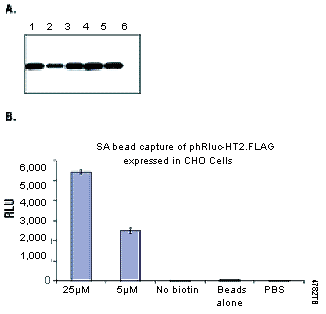
图7. 包被有链亲和素的磁颗粒对HaloTag™ 融合蛋白的有效捕获。CHO-K1细胞瞬时转染HaloTag™ pHT2载体,该载体编码Renilla荧光素酶-HaloTag™ –FLAG融合蛋白。细胞在无HaloTag™ 生物素配基和有该配基条件下(5μM或25μM,15分钟,37℃)培养。细胞被裂解,生物素标记蛋白被链亲和素包被的磁颗粒(Cat.# Z5481)捕获。图7A:以抗-FLAG抗体M2(Sigma)做Western blot分析。泳道1,细胞裂解液(+配基);泳道2,未结合的蛋白(+配基);泳道3,结合的蛋白(+配基);泳道4,细胞裂解液(-配基);泳道5,未结合的蛋白(-配基);泳道6,结合的蛋白(-配基)。图7B:使用Renilla荧光素酶底物(Part#E289B)来检测捕获的荧光素酶的活性。仪器为Orion Microplate 发光检测仪 (Berthold检测系统)。
参考文献
1. Giuliamo, K.A. and Taylor, D.L. (1998) Trends
Biotechnol. 16, 135-140.
2. Chapman-Smith, A. and Cronan, J.E. (1999) Trends
Biochem. Sci. 24, 359-63.
3. Cornish-Bowden. (1995) In: Fundamentals of
Enzyme Kinetics, pp. 1-17.
4. Qureshi, M.H. et al. (2001) J. Biol. Chem. 276,
46422-8.