| 摘
要
在过去的几年,Caspase检测得到了显著的改善。以前,Caspase检测相对比较不太并需要制备浓缩的细胞提取物。现在,Caspase检测极端灵敏;可以直接在多孔细胞培养板上进行检测,而且这些均质检测方法都有生物发光及荧光版本。随着这些改善,在数据分析时需要特别注意的问题也随之产生。在设计细胞凋亡示例及分析均质Caspase检测数据时,有数个与细胞系统相关的特点必须加以考虑。几个与检测生物发光的Caspase-GloTM的相关问题使这些特点更为突出。
| Caspase-GloTM3/7检测的灵敏度使其能够检测单独存在于血清中的Caspase活性,并且检测到的未处理细胞中的生物发光信号地落在检测的线形范围内。 |
为什么在未处理细胞中有较高的生物发光背景信号?
细胞凋亡在所有的培养细胞中以其固有的比率发生。转化的、无限增殖细胞有较高的增殖速度。有证据表明,较高的细胞凋亡速度可能是转化细胞的一种适应机制。在营养受限的环境中,它可以帮助维持稳定的活性细胞数量(1)。如果不考虑这一机制,未处理细胞中的信号主要是Caspase活性,而不是被定义为非特异信号的背景。请记住,在未处理细胞中存在Caspase活性而且可以通过设置“无细胞”对照将其与背景区别开来。测定不含细胞的培养基中的信号可以比较准确地反映与自发细胞凋亡无关的背景。与细胞无关的生物发光信号主要来自于血清。可以使用Caspase选择性抑制因子消除血清中Caspase
3/7样活性。血清中或常见的多孔细胞培养板上的未处理细胞中的Caspase活性的量低于或接近以前Caspase检测方法的极限。但是,Caspase-GloTM
3/7检测的灵敏度使其能够检测单独存在于血清中的Caspase活性并且检测到的未处理细胞中的生物发光信号很好地落在检测的线性范围内。下面的例子说明了生物发光
Caspase-GloTM 3/7检测的灵敏度是如何使得未处理细胞中的信号显得比较高。Caspase-GloTM检测与Apo-One®
检测的比较显示:未处理细胞中的生物发光信号明显的区别于无细胞对照信号,但是未处理细胞中的的荧光信号只比无细胞对照荧光信号高出少许。图1说明未处理细胞中明显存在Caspase-GloTM
3/7活性。
|
|
| 表1. Caspase-GloTM检测发现在未处理细胞中明显存在Caspase-GloTM
3/7活性。将Jurkat细胞培养于含10%牛血清的PRMI-1640培养基中,用Fas抗体(anti-Fas,
100ng/ml)处理细胞或不处理。将细胞接种于96孔板中,密度为10,000细胞/孔。Fas抗体处理细胞4小时后,向所有含有细胞及只含有细胞培养基的对照孔中加入Caspase-GloTM检测试剂或Apo-One®
均质检测试剂。1小时后-生物发光最佳检测时间,用适于每一检测的发光光度计或荧光光度计读数。 |
| RLU=相对光单位, RFU=相对荧光单位, S.D.=标准差。 |
| |
Caspase-GloTM检测(RLU) |
Apo-One®检测(RFU) |
|
处理 |
未处理 |
无细胞 |
处理 |
未处理 |
无细胞 |
RLU或RFU |
143,757.5 |
17,380
|
2,136.3
|
2,804.8
|
1,565.3
|
|
S.D. |
2663.5 |
719.6 |
82.3 |
235.7 |
30.8 |
38.1 |
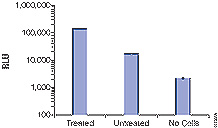
图1. 未处理培养细胞具有明显的Caspase 3/7活性。表1中Caspase-GloTM检测结果的对数图。
如何将Caspase-GloTM检测与其它方法进行比较?各种方法的信号/背景比值是乎是一致的。
在上面的Jurkat细胞实例中,可以分析不同的参数,对检测进行评估。信号/背景比值与信号/噪音比值是评价细胞检测的标准方法且每个参数提供的是不同的信息。信号/背景比值定义为平均信号/平均背景。但是,正如前面讨论的一样,可以用不同的方法定义细胞系统中的背景。在细胞系统中,信号/背景比值可以典型地定义为:
|