美国德克萨斯大学安德森癌症研究中心Farhad R. Danesh教授主要从事肾脏病理的基础与临床研究。近期,其实验室通过Arraystar RNA-seq发现lncRNA分子——Tug1在糖尿病小鼠体内低表达。表达谱芯片及Arraystar CHIRP-seq等证明,Tug1能够直接结合PGC-1α和Ppargc1α 上游启动子区TBE元件,促进Ppargc1α基因表达,并最终影响糖尿病患者足细胞线粒体生物能。该研究成果刊登在国际顶级医学期刊Journal of Clinical Investigation(IF=12.81)。(RNA-seq、表达谱芯片、CHIRP-seq由Arraystar提供技术服务)
研究背景
糖尿病性肾病(DN)是美国常见的糖尿病微血管并发症,也是导致晚期肾病的罪魁祸首。在DN病理相关因子的研究中发现,过氧化物酶体增殖物激活受体γ的辅因子1α(PGC-1α,由Ppargc1α 编码)在糖尿病患者体内明显低表达,该因子能够调控线粒体内容物和氧化磷酸化基因的表达,证明其在线粒体生物能和呼吸功能的调控中处于核心地位。PGC-1α 处于一个自体调节循环,参与其调节的相关因子,都与细胞能量和线粒体内稳态相关。鉴于PGC-1α是联结生理刺激与线粒体生物能的关键因子,其调控必然是严谨多层次的,一些新的调控PGC-1α的机制值得一探。lncRNA参与调控PGC-1α的角色一直鲜为人知,Farhad R. Danesh教授的主要研究目的在于揭示进化上保守的lncRNA-Tug1,调控PGC-1α的表达,并深入探讨其调控原理。
研究思路
为了探究LncRNA-Tug1在DN发生发展过程中的作用,本次研究应用美国Arraystar RNA-seq平台分析II型糖尿病小鼠与正常小鼠肾小球的转录本,筛选差异表达的lncRNA。其中lncRNA-Tug1在糖尿病小鼠体内表达下调。体外足细胞的葡萄糖压力实验和小鼠体内LOF和GOF验证Tug1与DN的发展有关。
为了探究Tug1调控DN的机制,作者敲低小鼠足细胞的LncRNA-Tug1 。表达谱芯片分析其转录组,找到与Tug1相关的400个上调基因和近560个下调基因。GO分析发现,Tug1参与调控几条代谢和生物合成路径,且与PCG-1α相关的基因簇,在Tug1敲低的小鼠体内显著低表达。PCG-1α是线粒体功能的主要调控因子,在糖尿病患者体内显著低表达,Tug1与PCG-1 α联系,成为DN发生的研究重点。挖掘Tug1与PCG-1 α联系时,作者首先证明Tug1通过调控PCG-1α的表达影响线粒体生物能,确定Tug1的作用靶标,并将研究重点聚焦与Tug1调控PCG-1α表达的机制。通过motif分析和CHIRP-seq,作者找到与Tug1结合的Ppargc1 α上游启动区域的TBE元件。promoter-luciferase和敲除实验,证明Tug1与Ppargc1α启动子上游TBE元件相互作用,调控PCG-1α的表达。 Ppargc1 α的表达是自调控的。作者随即通过RNA IP和 Pull-down证明Tug1直接结合PCG-1α蛋白CTD区域的R/S domain; PGC-1α的CHIP实验证明有大量TBE富集。从而揭示了Tug1与TBE的结合会招募PCG-1α蛋白,从而实现Ppargc1α的表达调控。
技术路线
结果展示
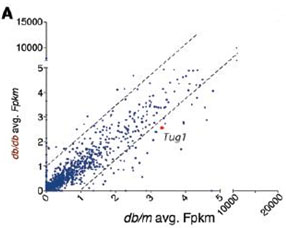
图一 RNA-seq分析差异表达lncRNA
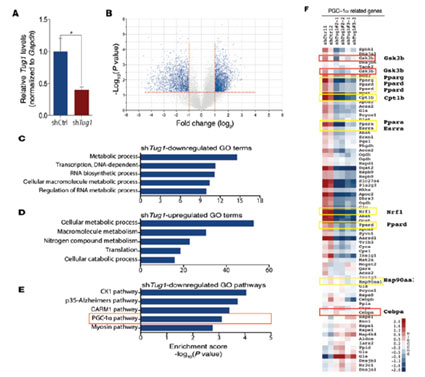
图二 表达谱芯片分析,与PGC-1α pathway相关的基因显著下调
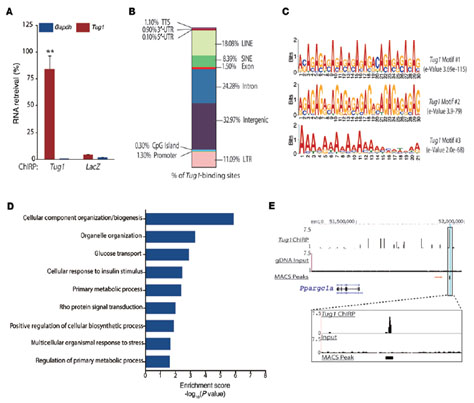
图三 CHIRP-seq分析揭示Tug1结合位点
研究意义
该研究揭示了LncRNA-Tug1作用于线粒体生物能的机制。LncRNA-Tug1通过结合Ppargc1α基因启动子上游TBE元件,招募PGC-1α蛋白,并与其CTD区R/S domain结合,实现Ppargc1α基因的自调控,进而影响线粒体生物能。为DN病理探索和治疗提供了新思路。
作者介绍
Farhad R. Danesh ,美国德克萨斯大学安德森癌症中心教授,贝勒医学院教授。多年从事肾病领域的研究,在经典肾病杂志JASN发表多篇论文。此外,还在cell metabolism、Nature communication、Kidney International等国际著名刊物中发表论文50余篇。期间还领导了NIH/NIDDK支持项目Mechanisms of protein-energy wasting in chronic kidney disease、Rho Kinases in diabetic nephropathy,在肾病研究领域首屈一指。
原文出处
Long noncoding RNA Tug1 regulates mitochondrial bioenergetics in diabetic nephropathy. JCI.2016

|




