
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基于PafA介导邻近标记的APPLE-MS技术:高灵敏度解析弱相互作用及膜蛋白互作网络的新方法
【字体: 大 中 小 】 时间:2025年09月09日 来源:Cell Reports Methods 4.5
编辑推荐:
针对传统亲和纯化-质谱(AP-MS)在检测弱/瞬时相互作用及膜蛋白互作(PPI)的局限性,Luo等开发了结合Twin-Strep标签富集与PafA介导邻近标记的APPLE-MS技术。该方法灵敏度提升4.07倍,成功揭示SARS-CoV-2 ORF9B动态互作组和PIN1内源性互作网络,为病毒-宿主互作研究和药物靶点发现提供新工具。
在生命科学研究中,蛋白质相互作用(PPI)网络如同城市交通网般复杂精妙,80%以上的蛋白质需要通过"社交"形成复合体才能发挥作用。然而现有的"社交记录仪"——亲和纯化-质谱(AP-MS)技术存在明显局限:就像用渔网捕捉蝴蝶,既容易漏掉弱相互作用(KD>100μM),又难以记录转瞬即逝的结合事件(t1/2<2分钟),更无法在细胞膜这样的特殊"社交场所"开展工作。这些问题严重制约着病毒-宿主互作、GPCR信号传导等关键领域的研究进展。
为突破这些技术瓶颈,来自上海交通大学和临港实验室的Luo Shihan等研究者开发了名为APPLE-MS的创新方法,巧妙融合了两种技术优势:Twin-Strep标签提供的高特异性"定位系统",加上细菌酶PafA的"分子快照"功能。这种组合就像给蛋白质装上智能手环,既能精确定位,又能即时记录所有"社交动态"。相关成果发表在《Cell Reports Methods》上,为解析生物分子互作提供了全新工具。
研究团队运用三项核心技术:1)建立模块化APPLE-MS系统,利用PafA酶将PupE共价标记在互作蛋白的赖氨酸上;2)采用CRISPR-Cas9在内源性PIN1基因插入Twin-Strep标签,实现生理条件下的互作组分析;3)开发原位膜蛋白标记方案,直接在活细胞表面进行邻近标记,避免传统膜蛋白提取导致的互作丢失。实验样本包括过表达SARS-CoV-2 ORF9B的HEK293T细胞、内源性PIN1敲入细胞系以及大鼠胰岛β细胞系INS-1E。
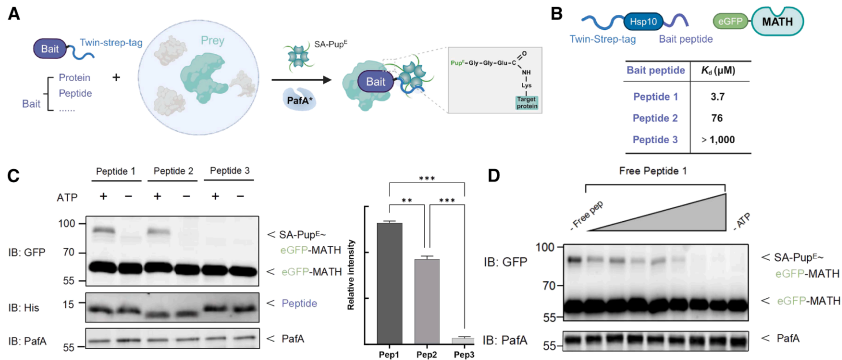
"Sensitive and specific affinity purification-mass spectrometry assisted by PafA-mediated proximity labeling"部分验证了技术可行性。通过SPOP MATH结构域与不同亲和力肽段(3.7μM至>1mM)的模型系统,证实APPLE-MS可稳定检测KD达76μM的弱相互作用,较传统AP-MS提升一个数量级。竞争实验显示游离肽段能剂量依赖性抑制标记效率,证实互作特异性。
"APPLE-MS to identify the ORF9B interactome"部分揭示了SARS-CoV-2免疫逃逸蛋白ORF9B的全面互作图谱。线粒体定位实验显示ORF9B与TOMM70显著共定位,免疫印迹验证其互作。相比传统AP-MS,APPLE-MS鉴定出更多已知互作蛋白(如RBM19、RAVER1等),信号噪声比提升4.07倍。GO分析发现ORF9B显著富集于RNA加工、线粒体氧化还原等通路,提示其通过劫持宿主mRNA处理机制促进病毒复制。
"APPLE-MS to identify the dynamic interactome of ORF9B"部分通过poly(I:C)模拟病毒感染,解析ORF9B互作组的时相变化。Mfuzz聚类分析将104个互作蛋白分为4类:早期(0-6h)靶向TCA循环酶,中期(6-18h)招募氧化磷酸化复合体,晚期(>18h)则出现线粒体蛋白输入抑制。这种阶段性调控显示ORF9B如同"代谢劫匪",逐步重编程宿主能量代谢以满足病毒需求。
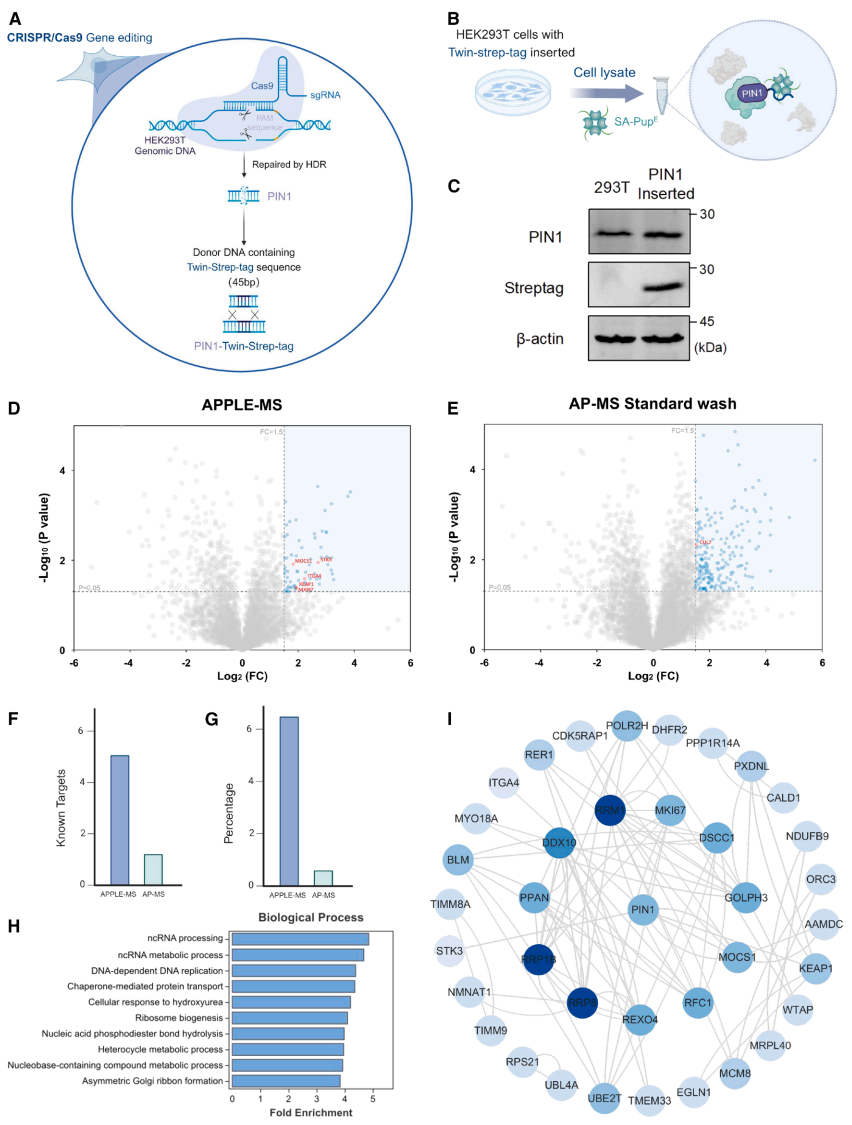
"APPLE-MS for studying endogenous PPIs"部分展示了技术在内源蛋白研究中的优势。通过CRISPR在PIN1基因C端插入仅3kDa的Twin-Strep标签,成功鉴定出78个高置信度互作蛋白,包括DNA复制机器成分(MCM复合物、RFC1)和细胞周期调控因子MNAT,揭示PIN1在基因组稳定性维持中的新功能。
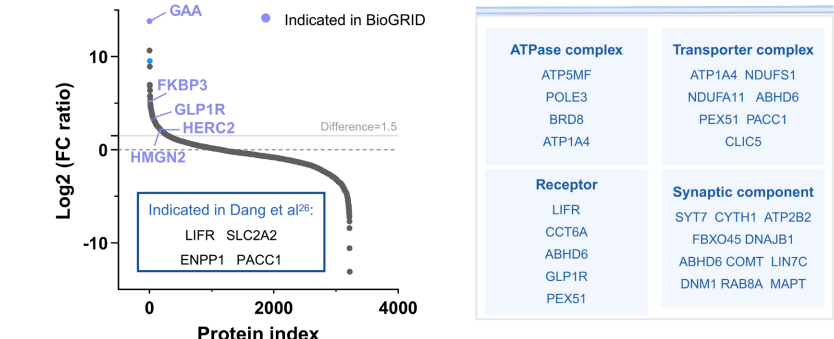
"APPLE-MS to identify membrane interactors"部分突破性地实现了膜受体原位互作分析。在表达GLP-1R的HEK293T细胞和INS-1E胰岛β细胞中,APPLE-MS鉴定出301个互作蛋白,包括ATP酶(ATP5MF)、脂滴蛋白PLIN2等新调控因子,为理解GLP-1的降糖机制提供新视角。
这项研究建立的APPLE-MS技术具有三重创新价值:方法学上,首次将PafA邻近标记与Twin-Strep纯化整合,实现"一管式"操作;技术上,3kDa小标签避免了大融合蛋白(如TurboID的28kDa)对天然互作的干扰;应用上,既能解析病毒蛋白的动态互作,又能绘制膜受体的原位互作图谱。相比现有技术(如表1所示),APPLE-MS在检测弱相互作用、膜蛋白研究和内源标记方面具有独特优势。
该技术为多个领域带来突破:在病毒学领域,ORF9B互作组的动态解析为开发广谱抗冠状病毒药物提供新靶点;在代谢疾病研究中,GLP-1R复合物的发现可能启发新一代降糖药物设计;更广泛地,这种模块化设计可推广至各类PPI研究,特别是那些"难以捕捉"的瞬时相互作用和膜相关复合物。正如研究者所言,APPLE-MS如同给蛋白质互作研究装上"高精度雷达",未来通过与冷冻电镜等技术的联用,有望实现从互作发现到结构解析的全链条研究。
 生物通微信公众号
生物通微信公众号
知名企业招聘