
-

生物通官微
陪你抓住生命科技
跳动的脉搏
整合人类遗传学与功能筛选证据揭示肥胖和脂肪分布调控通路
【字体: 大 中 小 】 时间:2025年09月05日 来源:AJHG 9.8
编辑推荐:
本研究通过结合英国生物银行(UK Biobank)40万欧洲人群的外显子测序数据与CRISPR基因敲除实验,系统鉴定了SLTM、PPARG和COL5A3等调控脂肪积累的关键基因。研究人员创新性地将罕见变异关联分析(SKAT-O p<1.58×10-7)与脂肪细胞功能验证相结合,发现PPARG敲除显著降低脂质积累(FC=0.25),而COL5A3敲除则增加脂质积累(FC=1.72),为肥胖和脂肪分布异常提供了新的治疗靶点。
在全球肥胖率持续攀升的背景下,脂肪组织的异常积累已成为心血管疾病和代谢紊乱的重要诱因。有趣的是,脂肪分布模式比总体肥胖更能预测疾病风险——苹果型(中心性肥胖)人群患病风险显著高于梨型(臀股部肥胖)人群。然而,目前针对脂肪分布异常的靶向治疗手段仍然有限,这很大程度上源于对相关遗传机制的认知不足。传统研究多聚焦于常见变异,而对罕见变异在脂肪分布调控中的作用知之甚少。
为破解这一难题,由Nikolas A. Baya和Cecilia M. Lindgren领衔的国际团队在《AJHG》发表了一项突破性研究。研究人员创新性地整合了英国生物银行(UK Biobank)402,375名欧洲裔参与者的外显子测序数据与人类白色脂肪细胞(hWAT)的CRISPR功能筛选,构建了从基因变异到分子功能的完整证据链。研究采用SAIGE混合模型进行基因水平关联分析,通过BODIPY荧光染色定量脂质积累,并运用RNA-seq解析转录组变化。
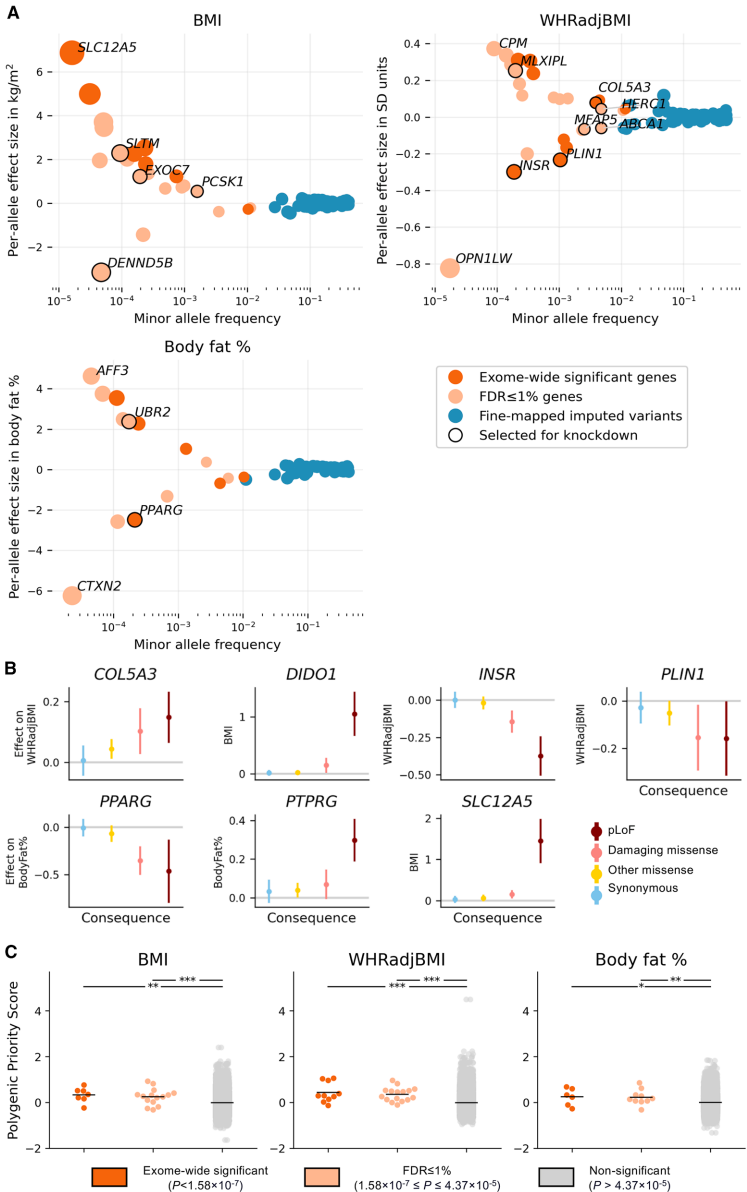
在"Discovery of genes associated with obesity and fat distribution through exome-wide association tests"部分,研究团队鉴定出19个与肥胖或脂肪分布显著相关的基因(SKAT-O p<1.58×10-7)。其中PPARG和GPR151变异携带者体脂率显著降低,而MC4R和RIF1变异则导致肥胖风险增加。值得注意的是,PLIN4变异同时与较低体脂率和较高腰臀比(WHRadjBMI)相关,提示其可能通过减少臀股部脂肪来改变脂肪分布模式。
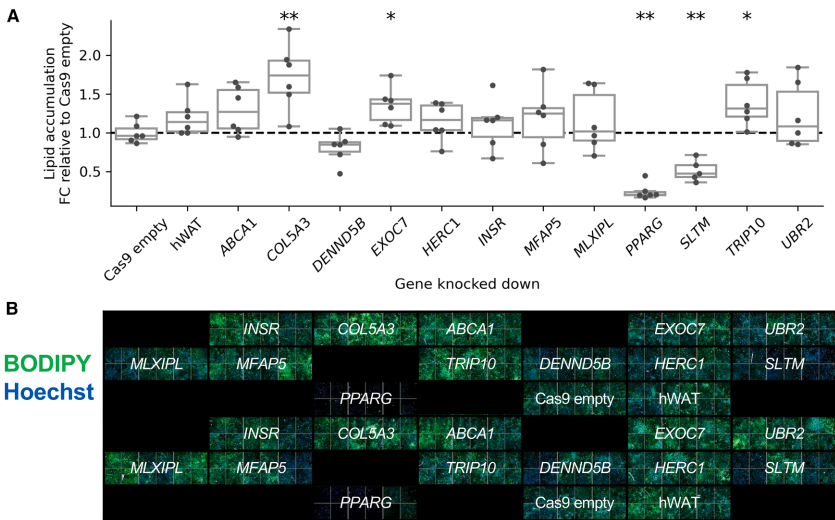
"Knockdown of obesity- and fat distribution-associated genes alters in vitro adipogenesis and lipid accumulation"部分揭示了关键基因的功能影响。PPARG敲除使脂质积累降低75%(p=5.52×10-7),验证了其作为脂肪生成主调控因子的地位。而SLTM(一种GLI转录因子调节蛋白)敲除意外导致脂质积累减少51%(p=1.91×10-4),尽管其罕见功能缺失变异与较高BMI相关,这种矛盾提示可能存在组织特异性效应。COL5A3敲除则显著增加脂质积累(FC=1.72),表明细胞外基质成分在脂肪细胞分化中的重要作用。
"Transcriptome-wide effects of gene knockdowns"部分通过GSEA分析发现PPARG敲除影响了95条信号通路(FWER p<0.05),包括PRC2介导的DNA甲基化和组蛋白乙酰化等表观遗传调控机制。MLXIPL(碳水化合物反应元件结合蛋白ChREBP)虽未改变脂质积累,但显著干扰了干扰素α/β信号通路(p=0.0016),揭示了糖代谢与免疫反应的潜在关联。
这项研究通过多组学整合策略,建立了罕见变异与脂肪分布表型的因果关系。其创新性体现在三个方面:首先,发现SLTM等新靶点拓展了对脂肪分布调控的认知;其次,证实COL5A3等细胞外基质基因的意外作用,提示脂肪组织微环境的重要性;最后,建立的hWAT细胞模型为后续药物筛选提供了理想平台。特别是发现PPARG和SLTM的双向调控作用,为开发选择性调节不同脂肪库的药物指明了方向。这些发现不仅深化了对肥胖异质性的理解,更为精准治疗脂肪分布异常提供了分子靶标,具有重要的临床转化价值。
 生物通微信公众号
生物通微信公众号
知名企业招聘