
-

生物通官微
陪你抓住生命科技
跳动的脉搏
蛋白激酶D3(PKD3)通过调控Rab7维持内溶酶体稳态并促进三阴性乳腺癌干细胞特性的机制研究
【字体: 大 中 小 】 时间:2025年09月04日 来源:iScience 4.1
编辑推荐:
本研究聚焦三阴性乳腺癌(TNBC)中蛋白激酶D3(PKD3)的生物学功能,揭示了其通过定位晚期内体调控Rab7依赖的内溶酶体稳态的新机制。研究人员发现PKD3缺失导致Rab7及逆转运复合体(retromer)募集异常,引发溶酶体酸化障碍和Cathepsin D分泌失调,进而通过Wnt/β-catenin通路影响肿瘤干细胞特性。该研究为TNBC靶向治疗提供了新靶点,发表于《iScience》并采用CRISPR/Cas12a标记、3D培养等前沿技术,深化了对激酶时空调控的认知。
研究背景与科学问题
在肿瘤生物学领域,三阴性乳腺癌(TNBC)因其侵袭性强、治疗靶点稀缺而备受关注。蛋白激酶D家族(PKD)成员PKD3被发现在TNBC中高表达,尤其与肿瘤干细胞特性相关,但其具体作用机制如同"黑箱"。既往研究多聚焦PKD在分泌途径中的作用,而PKD3是否通过调控内膜系统影响肿瘤进展仍是未解之谜。更关键的是,内溶酶体系统失调与肿瘤耐药、转移密切相关,但激酶如何参与Rab7(内溶酶体关键调控因子)的功能调控尚属空白。
关键技术方法
研究采用多学科交叉技术:1)CRISPR/Cas12a辅助PCR标记实现内源性PKD3-mGFP定位;2)模拟肿瘤硬度的5 kPa聚丙烯酰胺(PAA)水凝胶3D培养系统;3)GST-RILP下拉实验检测Rab7活性;4)溶酶体探针LysoSensor定量酸化水平;5)免疫共沉淀分析Rab7-retromer互作。所有实验均在TNBC细胞系(MDA-MB-231/BT549)和HeLa模型中完成。
主要研究结果
1. 活性PKD3定位于内溶酶体膜
通过诱导表达PKD3-GFP和内源性标记(PKD3EN-mGFP),发现PKD3特异性富集于Rab7+/CD63+晚期内体,而与TGN46标记的高尔基体无共定位。3D培养显著增强PKD3膜定位,提示力学微环境调控激酶活性。
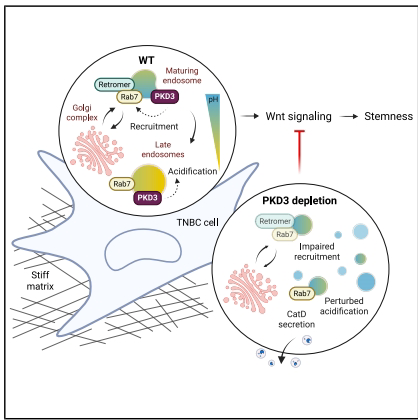
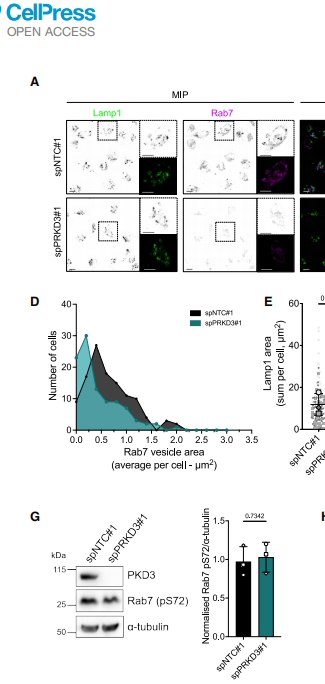
2. PKD3缺失导致Rab7空间重分布
siRNA敲低PKD3后,Rab7从Lamp1+溶酶体解离,转为分散于胞内小囊泡。定量分析显示Rab7荧光强度降低40%,但磷酸化(S72)和GTP结合状态未变,表明PKD3调控Rab7膜定位而非活性。
3. Retromer功能受损引发CatD分泌异常
PKD3缺失使逆转运复合体亚基Vps35与Rab7共定位减少50%,导致未成熟CatD在胞内累积且分泌增加2.3倍,证实PKD3通过Rab7-retromer轴调控溶酶体酶分选。
4. 溶酶体酸化障碍影响Wnt信号
LysoSensor检测显示PKD3敲除细胞溶酶体pH值升高,且CHIR99021(GSK3β抑制剂)无法激活β-catenin。Axin2 mRNA表达下降60%,揭示PKD3通过维持内溶酶体酸化促进Wnt通路活化。
结论与意义
该研究首次阐明PKD3-Rab7-retromer分子轴:PKD3作为"空间导航器"确保Rab7正确定位晚期内体,进而维持溶酶体酸化及逆转运功能,最终通过Wnt通路调控肿瘤干细胞特性。这一发现为TNBC提供了新的治疗策略——靶向PKD3内溶酶体功能可能同时抑制肿瘤生长与干性。研究还创新性地揭示力学微环境(3D培养)对激酶膜定位的调控,为肿瘤异质性研究提供了新视角。
局限性在于内源性PKD3定位尚未在TNBC细胞中完全验证,且直接作用底物有待磷酸化组学鉴定。未来研究可探索PKD3与Rab7效应蛋白(如TBC1D5)的互作机制,以及其在临床样本中的表达模式与预后关联。
 生物通微信公众号
生物通微信公众号
知名企业招聘