
-

生物通官微
陪你抓住生命科技
跳动的脉搏
高保真CRISPR-Cas9靶向KRAS驱动突变在肺癌临床前模型中的治疗突破
【字体: 大 中 小 】 时间:2025年09月02日 来源:Nature Communications 15.7
编辑推荐:
本研究针对KRASG12C/KRASG12D突变型非小细胞肺癌(NSCLC)的治疗难题,开发了基于HiFiCas9的基因编辑疗法。通过设计特异性sgRNA,研究人员实现了对致癌突变的选择性敲除,在细胞模型、CDX和PDX模型中显著抑制肿瘤生长。该策略克服了Sotorasib的耐药性问题,为KRAS突变型肺癌提供了更精准的治疗方案。
肺癌作为全球癌症相关死亡的首要原因,其中KRAS基因突变在肺腺癌(LUAD)患者中检出率高达32%。尽管KRASG12C抑制剂Sotorasib的上市为治疗带来希望,但其临床响应率仅36%,且存在获得性耐药等问题。更棘手的是,KRASG12D突变至今缺乏靶向药物。KRAS蛋白的"不可成药性"和突变特异性靶向难题,促使科学家寻求基因层面的解决方案。
这项发表在《Nature Communications》的研究创新性地采用高保真Cas9变体(HiFiCas9),通过精确区分单核苷酸差异,实现对KRASG12C和KRASG12D的特异性编辑。研究团队设计了两套靶向系统:P1-sgRNA-KRASG12C和P2-sgRNA-KRASG12D,通过核糖核蛋白(RNP)和腺病毒(AdV)两种递送方式,在多种临床前模型中验证治疗效果。
关键技术方法包括:1)使用T7核酸内切酶实验和NGS测序验证编辑效率;2)建立2D/3D细胞培养、细胞源性异种移植(CDX)和患者来源异种移植(PDX)模型;3)通过Western blot分析KRAS下游信号通路;4)比较HiFiCas9与Sotorasib的疗效差异;5)利用Sotorasib耐药细胞系评估治疗潜力。研究使用的PDX模型来自西班牙Virgen del Rocío医院和12 de Octubre医院的肺癌患者样本。
【CRISPR-HiFiCas9实现KRAS驱动突变的高效特异性靶向】
研究人员首先验证了编辑系统的特异性,在KRASWT细胞中未检测到编辑活性。通过引入单碱基错配的sgRNA,证实系统能精确区分KRASG12C(c.34G>T)和KRASG12D(c.35G>A)突变。NGS分析显示,在H358(KRASG12C)细胞中主要产生2nt缺失,而在A427(KRASG12D)细胞中则以1nt插入为主。Cas-OFFinder预测的脱靶位点ABI3BP和SIPA1L3经实验验证均未发生非特异性编辑。
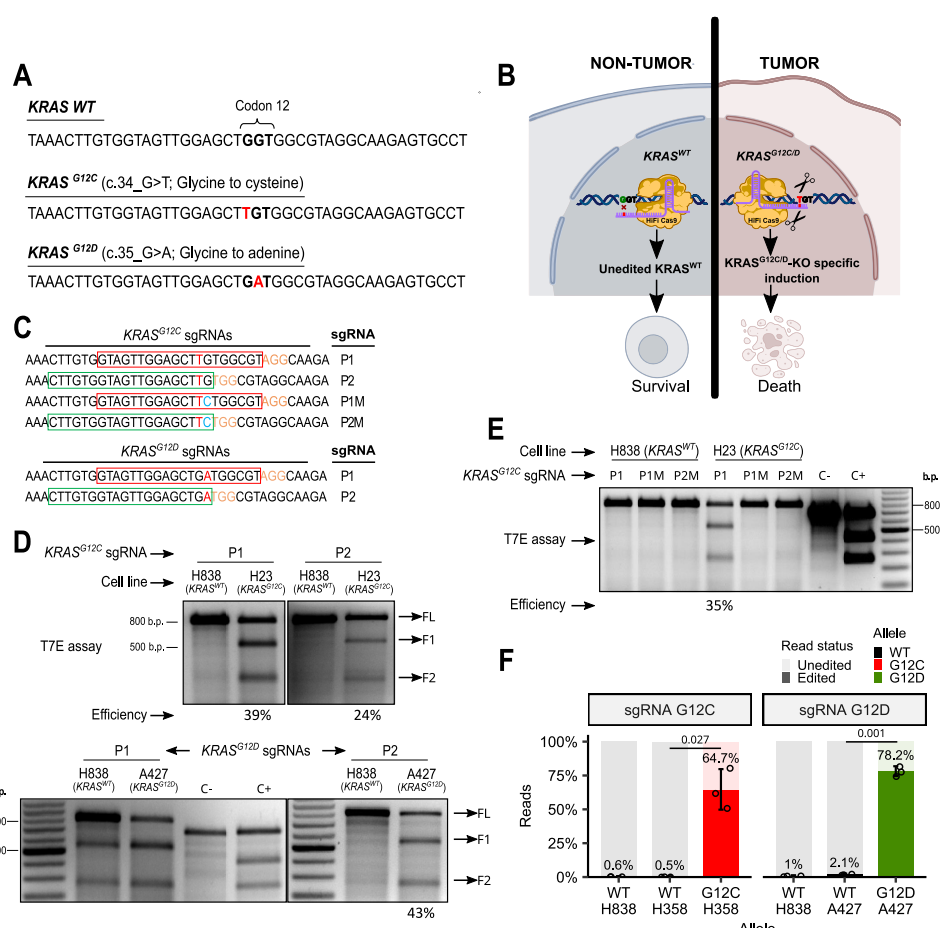
【HiFiCas9介导的KRAS靶向抑制突变细胞系活力】
RNP转染7天后,KRASG12C细胞系H358和H1792存活率分别降至67%和26%,KRASG12D细胞系A427和SK-LU-1存活率降至36%和32%。Western blot显示编辑后KRAS蛋白显著减少,下游效应分子p-ERK和p-p70S6K磷酸化水平降低。值得注意的是,3D培养模型中疗效更显著,H358和A427细胞活力分别降低70%和75%,更接近体内肿瘤微环境特征。
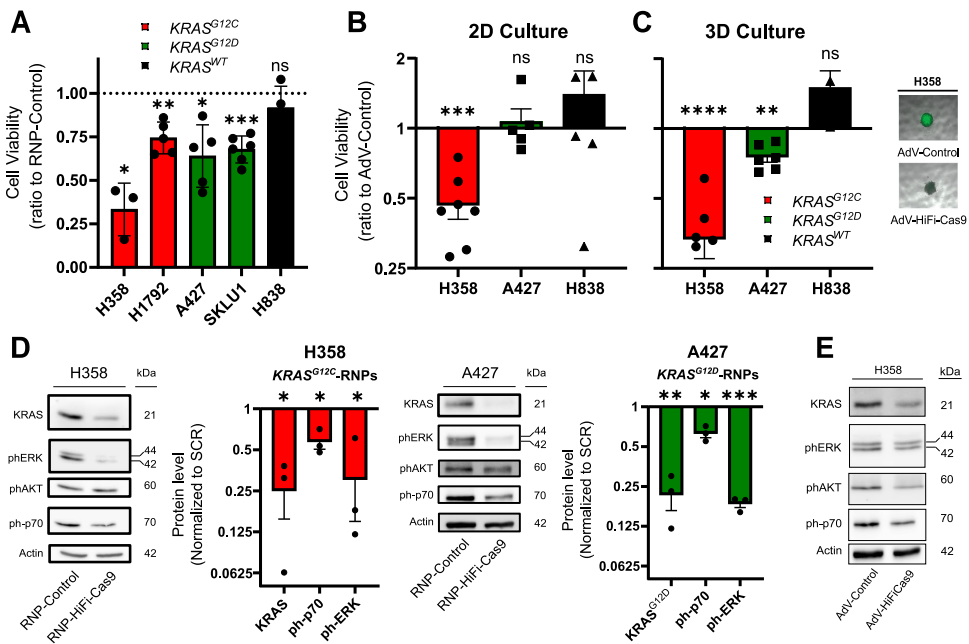
【HiFiCas9介导的KRAS靶向抑制肺癌异种移植模型肿瘤生长】
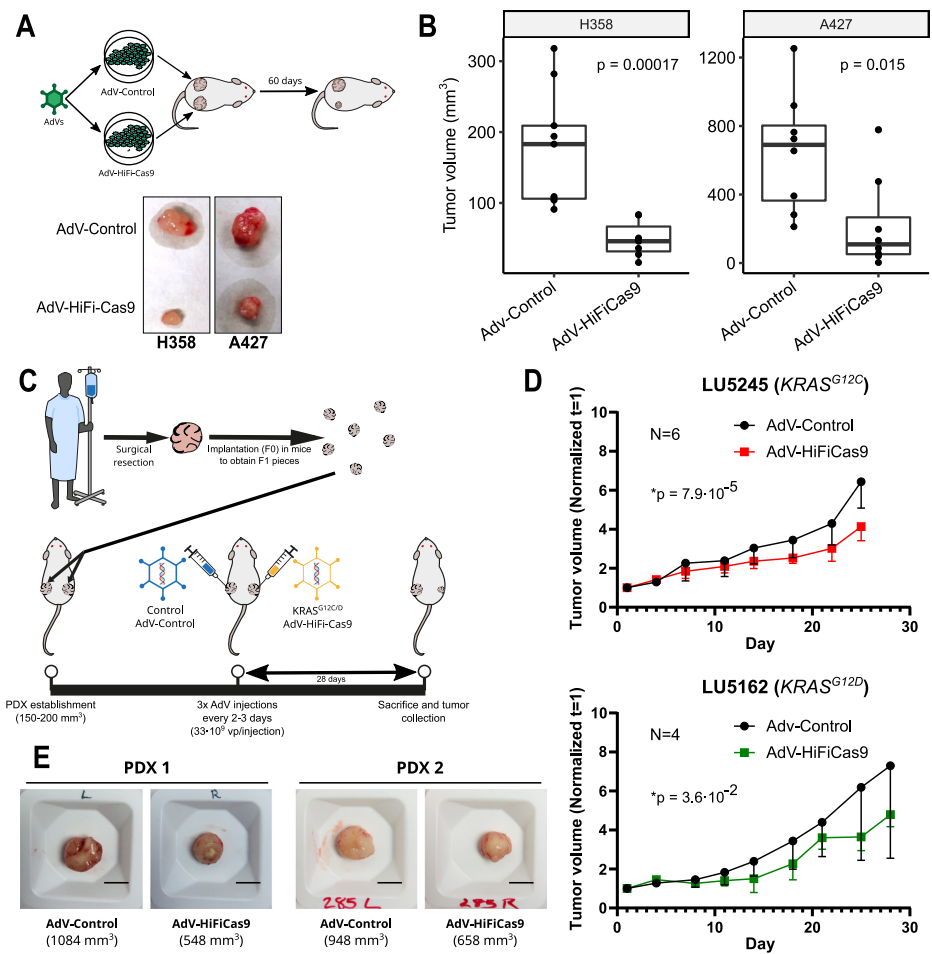
在CDX模型中,AdV-HiFiCas9预处理使H358(KRASG12C)和A427(KRASG12D)移植瘤体积分别减小63%和42%。PDX模型进一步证实治疗效果,线性混合效应模型分析显示,LU5245(KRASG12C)和LU5162(KRASG12D)肿瘤生长速率显著降低(p=7.9×10-5和p=0.036)。免疫组化显示Ki67和Cleaved Caspase 3无显著变化,提示疗效主要源于编辑细胞的清除。
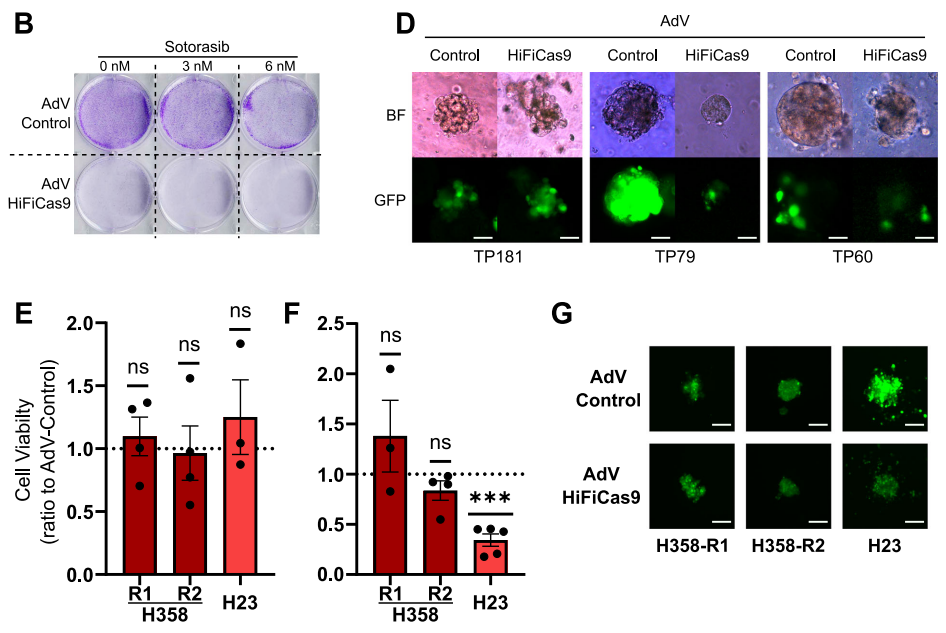
【HiFiCas9疗法相较Sotorasib的优势】
在H358细胞中,HiFiCas9的抑瘤效果优于6nM Sotorasib(IC50浓度)。PDXO实验显示,TP79类器官对Sotorasib耐药但对HiFiCas9敏感,TP60类器官对两者均敏感,而TP181类器官对两者均不响应,反映了临床反应的异质性。在携带KEAP1/SMARCA4共突变的Sotorasib耐药H23细胞中,HiFiCas9仍能降低60%的3D培养细胞活力。连续三轮RNP处理未发现耐药性产生,NGS检测未发现逃逸性突变。
这项研究开创性地证明了HiFiCas9系统可特异性靶向KRAS致癌突变,克服了当前KRAS抑制剂的三大局限:1)仅针对KRASG12C的局限性;2)依赖GDP结合状态的机制缺陷;3)获得性耐药问题。通过基因水平消除致癌驱动因子,该策略避免了蛋白抑制剂面临的信号通路代偿激活问题。研究还揭示了3D培养模型在预测治疗响应中的重要性,为临床转化提供了可靠评估体系。
从转化医学角度看,该技术具有双重优势:治疗上可作为KRASG12D突变的首个靶向方案,也可解决KRASG12C抑制剂的耐药难题;机制上为研究KRAS驱动的免疫逃逸提供了新工具。虽然腺病毒递送效率仍需优化,但研究数据为开展临床试验奠定了坚实基础,未来可探索与免疫治疗的联合策略。这项由西班牙多个研究中心合作完成的成果,标志着基因编辑技术向肿瘤精准治疗迈出了重要一步。
 生物通微信公众号
生物通微信公众号
知名企业招聘