
-

生物通官微
陪你抓住生命科技
跳动的脉搏
GNAS R201突变与结直肠癌侵袭性的关联解析:肿瘤进展的新分子标记
【字体: 大 中 小 】 时间:2025年09月01日 来源:Scientific Reports 3.9
编辑推荐:
本研究针对结直肠癌(CRC)中GNAS基因c.602G>A(p.Arg201His)突变的临床意义展开探索。研究人员通过HRM(高分辨率熔解曲线分析)和测序技术,在40例CRC样本中发现35%存在该突变,并首次揭示其与肿瘤大小、淋巴转移及血管侵犯的显著相关性,为CRC分子分型及靶向治疗提供了新依据。
在全球癌症负担排名中,结直肠癌(CRC)长期占据第三大发病率和第二大死亡率的严峻位置。尽管诊疗技术不断进步,但肿瘤异质性和分子机制的复杂性仍导致临床预后差异显著。近年来,GNAS基因突变作为G蛋白信号通路的关键调控因子,在多种癌症中被发现具有促癌作用,但其在CRC中的具体作用机制尚不明确。特别是位于201密码子的热点突变(c.602G>A),可通过持续激活cAMP-PKA信号级联反应驱动肿瘤进展,这一现象在胰腺和胆管癌中已有报道,却在CRC领域存在研究空白。
为填补这一知识缺口,来自伊朗德兹富尔医科大学的Mohammad Amin Behmanesh团队在《Scientific Reports》发表了创新性研究成果。研究团队采用医院存档的40例CRC组织样本,通过高灵敏度HRM技术结合Sanger测序验证,系统分析了GNAS c.602G>A突变频率及其与临床病理特征的关联。样本来源于2015年以来的医院组织库,所有病例均经病理学家确诊。
流行病学和临床病理学结果
研究队列中72.5%为男性患者,GNAS突变检出率达35%(14/40),且男性携带者占比更高(57.1% vs 42.9%)。值得注意的是,64.3%的突变发生在组织学分级1级的肿瘤中,但这类"低级别"肿瘤却表现出侵袭性特征:21.4%的病例肿瘤直径超过5cm,35.7%存在淋巴浸润,25%发生血管转移。统计学分析揭示,肿瘤大小与淋巴转移(p=0.045)、血管侵犯(p=0.007)及性别(p=0.007)均存在显著相关性。
HRM和DNA序列分析
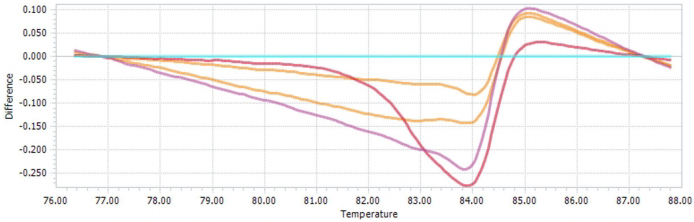
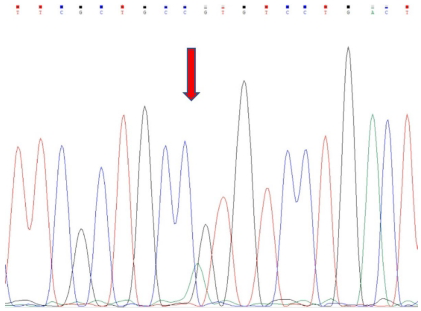
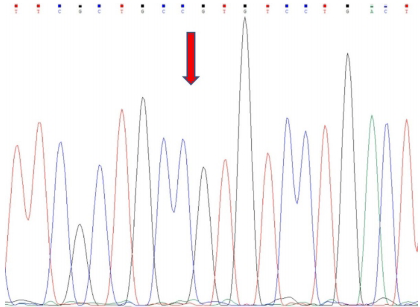
研究采用特异性引物扩增GNAS基因目标区域,通过熔解曲线差异成功区分野生型(GG)与杂合突变型(GA)。如图1所示,差异图中底部红色/粉色曲线代表GA基因型,中部蓝色基线为GG型。测序结果直观显示602位点G>A的碱基替换(图2箭头处),而野生型样本则保持GG纯合状态(图3)。
A
讨论与意义
该研究首次报道了中东人群CRC中GNAS c.602G>A突变的高检出率(35%),显著高于既往研究报道的5%全球平均水平。这种差异可能反映人群遗传背景或肿瘤亚型分布的特异性。尤为重要的是,研究发现该突变与肿瘤侵袭性特征的相关性,为解释临床上部分组织学低分级肿瘤却表现高侵袭性的现象提供了分子依据。
从转化医学角度看,GNAS突变导致的cAMP-PKA通路持续激活,可能使其成为靶向治疗的潜在靶点。已有研究表明,蛋白激酶A(PKA)抑制剂可阻断GNAS突变肿瘤的生长,这为CRC精准治疗开辟了新途径。研究同时指出,男性患者更高的突变携带率提示性别因素可能在GNAS相关致癌机制中扮演特殊角色,这一发现值得在更大队列中验证。
尽管存在样本量有限等局限性,该研究仍为CRC分子分型提供了重要线索。未来研究需整合KRAS、BRAF等基因变异数据,并探索GNAS突变与黏液性腺癌等特殊病理类型的关联。随着对GNAS信号网络认识的深入,针对该通路的治疗策略有望成为CRC个体化医疗的新选择。
 生物通微信公众号
生物通微信公众号
知名企业招聘