
-

生物通官微
陪你抓住生命科技
跳动的脉搏
中国卵巢癌患者同源重组缺陷亚组的基因组与转录组特征解析及其临床意义
【字体: 大 中 小 】 时间:2025年09月01日 来源:Human Genomics 4.3
编辑推荐:
本研究针对中国卵巢癌(OV)患者对PARP抑制剂联合化疗的差异化响应问题,通过多组学测序技术系统分析了同源重组缺陷(HRD)亚组的分子特征。研究发现HRD-high组TP53突变富集且STAT1高表达,免疫微环境中M1巨噬细胞浸润增强,ctDNA动态监测显示HRD-low组更易出现治疗耐药。该研究为HRD分层治疗提供了分子标志物和监测策略,发表于《Human Genomics》。
卵巢癌作为妇科恶性肿瘤中的"隐形杀手",其五年生存率不足60%,主要归因于治疗耐药和复发问题。近年来,PARP抑制剂(PARPi)为同源重组缺陷(HRD)患者带来曙光,但临床实践中发现近半数患者对PARPi联合化疗方案不敏感。这种治疗响应的异质性背后,隐藏着怎样的分子机制?中国患者群体是否存在独特的基因组特征?这些问题成为困扰临床精准治疗的关键瓶颈。
为破解这一难题,由河北省肿瘤医院和河北医科大学第四医院联合开展的研究,通过整合基因组、转录组和液体活检技术,绘制了中国卵巢癌患者HRD亚组的分子图谱。研究团队对143例中国卵巢癌患者进行HRD评分,筛选70例接受辅助治疗的患者开展多组学测序,并利用TCGA-OV队列进行验证,相关成果发表于《Human Genomics》。
关键技术方法包括:1) 基于811基因panel的靶向测序计算HRD评分;2) 使用scarHRD算法整合端粒等位基因失衡(TAI)、大规模状态转换(LST)和杂合性缺失(LOH)特征;3) 通过CIBERSORT和ImmunCellAI算法解析肿瘤免疫微环境;4) 对15例患者进行多时间点ctDNA动态监测。
HRD评分阈值的确立
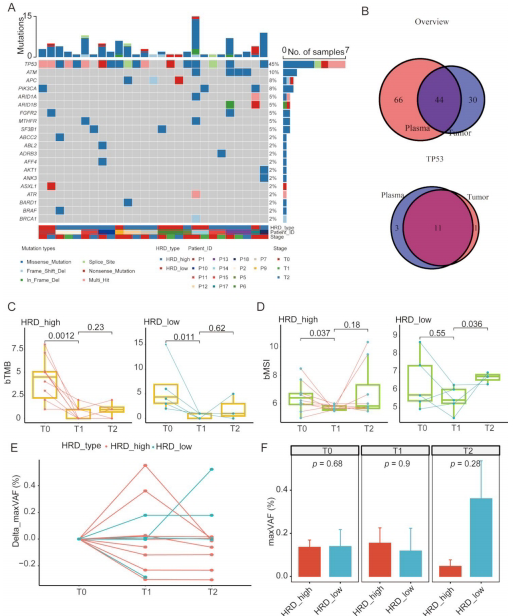
研究发现中国卵巢癌患者HRD评分≥43可有效区分91%的BRCA1/2突变携带者。测序深度>600X、肿瘤纯度>30%时评分结果稳定可靠,为临床检测提供质控标准。
基因组特征差异
HRD-high组呈现TP53突变富集(71%),与ARID1A/PIK3CA/PTEN突变互斥。这些突变分别影响干细胞多能性调控通路(HRD-high)和细胞周期通路(HRD-low),揭示了治疗响应的分子基础。
免疫微环境特征
转录组分析发现HRD-high组STAT1表达显著升高(p<0.01),HLA I特征评分增强,且M1巨噬细胞浸润增加。生存分析显示,HRD-high组中STAT1表达≥74或M1巨噬细胞高浸润患者总生存期(OS)显著延长。
ctDNA动态监测价值
外周血分析显示HRD-low组基线bMSI(血液微卫星不稳定性)和maxVAF(最大变异等位基因频率)更高。治疗过程中HRD-low组出现bMSI升高和maxVAF反弹,提示克隆演化导致的耐药风险。
研究结论强调,中国卵巢癌患者HRD-high亚组具有独特的"免疫活化"特征:TP53突变谱、STAT1-HLA I轴激活、M1巨噬细胞浸润构成三重保护机制。临床实践中,推荐对STAT1表达≥74的HRD-high患者优先选择PARPi治疗。同时,ctDNA中bMSI和maxVAF的动态变化可作为HRD-low组耐药预警的"液体活检"标志物。
这项研究首次系统揭示了中国人群HRD亚组的分子异质性,为PARPi的精准应用提供了"分子分型-免疫特征-动态监测"的完整决策框架。特别值得注意的是,STAT1作为新型预测标志物的发现,突破了传统HRD检测的局限性,为免疫治疗策略的优化开辟了新思路。未来需要扩大样本验证这些发现,并探索STAT1调控网络作为联合治疗靶点的潜力。
 生物通微信公众号
生物通微信公众号
知名企业招聘