
-

生物通官微
陪你抓住生命科技
跳动的脉搏
苦参酮通过激活Nrf-2信号通路减轻单侧输尿管梗阻诱导的肾损伤和纤维化研究
【字体: 大 中 小 】 时间:2025年08月31日 来源:Journal of Molecular Histology 2.2
编辑推荐:
本研究针对慢性肾脏病(CKD)中肾纤维化这一关键病理过程,发现天然产物苦参酮(KAR)能通过调控Keap1/Nrf-2通路抑制TGF-β1/Smad3信号轴,显著改善单侧输尿管梗阻(UUO)模型中的肾功能指标(BUN/SCr),促进M2型巨噬细胞极化,为开发新型抗纤维化药物提供了重要靶点。
慢性肾脏病(CKD)已成为全球第三大致死疾病,影响着超过1.6亿人的健康。这种疾病的进展与肾纤维化密切相关——就像皮肤受伤后会留下疤痕一样,肾脏在长期受损后也会形成"疤痕组织",最终导致肾功能丧失。目前临床上缺乏有效阻止肾纤维化的药物,而转化生长因子-β1(TGF-β1)及其下游的Smad3信号通路被认为是驱动这一过程的关键"元凶"。与此同时,科学家们发现Keap1/Nrf-2通路就像细胞内的"抗氧化总开关",它的激活可以对抗纤维化过程。这不禁让人思考:能否找到一种物质,既能抑制促纤维化的TGF-β1/Smad3通路,又能激活保护性的Nrf-2通路?
来自同济大学附属东方医院的研究团队将目光投向了传统中药苦参中的活性成分——苦参酮(Kurarinone, KAR)。这种黄酮类化合物此前已被发现具有抗炎和抗癌特性,但它在肾脏保护方面的潜力尚属未知。为此,研究人员在《Journal of Molecular Histology》发表了这项开创性研究,系统揭示了KAR通过"双管齐下"的作用机制对抗肾纤维化的全过程。
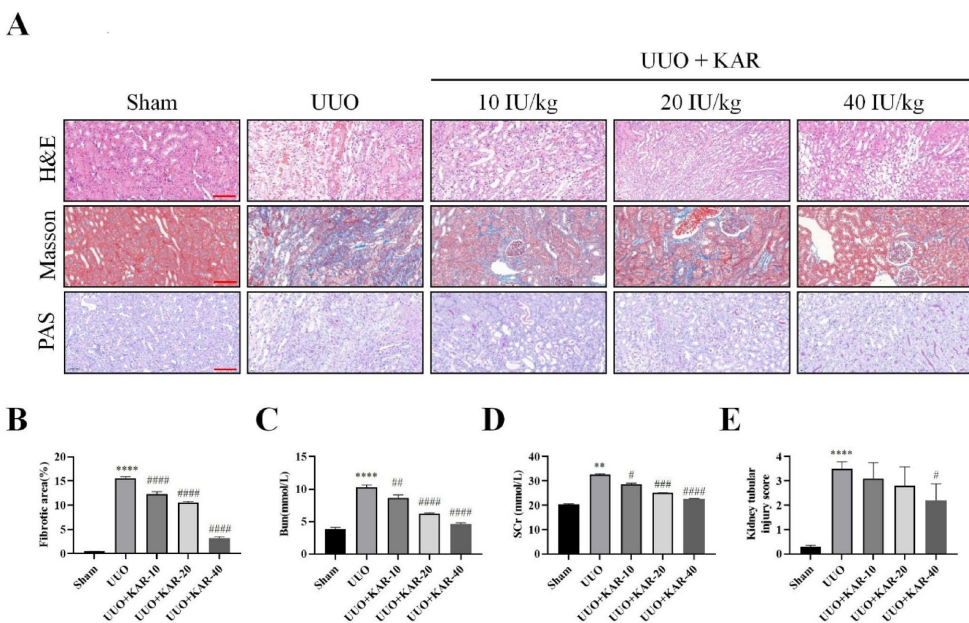
研究采用了体内外相结合的方法:在动物层面建立了经典的单侧输尿管梗阻(UUO)大鼠模型,设置假手术组、UUO模型组和低中高三个剂量KAR治疗组;在细胞层面则使用TGF-β1诱导人肾小管上皮细胞(HK-2)建立纤维化模型。关键技术包括:HE/Masson/PAS染色评估病理改变,免疫荧光检测α-SMA(α-平滑肌肌动蛋白)等纤维化标志物,Western blot分析Keap1/Nrf-2通路蛋白表达,以及使用Nrf-2抑制剂ML385和siRNA进行功能验证。
【KAR增强UUO模型肾功能】
通过经典的肾功能指标检测发现,与模型组相比,KAR治疗组血清尿素氮(BUN)和肌酐(SCr)水平显著降低。组织病理学分析显示,KAR各剂量组肾小管损伤评分明显改善,Masson染色显示的纤维化面积随剂量增加而递减,其中高剂量组(40 IU/kg)效果最为显著。
【KAR抑制纤维化并诱导M2型巨噬细胞极化】
免疫荧光结果显示,KAR能剂量依赖性地降低促纤维化标志物α-SMA的表达。更有趣的是,它还能增加M2型巨噬细胞标记物CD206的表达,同时减少总巨噬细胞标记物F4/80,这表明KAR可能通过调节免疫微环境来发挥保护作用。

【KAR通过抑制TGF-β1/Smad3通路改善纤维化】
分子水平检测显示,KAR能显著下调纤维化相关基因FN(纤维连接蛋白)、Snail1、Kim1的表达。Western blot证实KAR可抑制TGF-β1及其下游磷酸化Smad3(p-Smad3)的蛋白水平,这解释了其抗纤维化作用的分子基础。

【KAR激活Keap1/Nrf-2通路】
研究最关键的发现是揭示了KAR的作用靶点。在UUO模型和细胞实验中,KAR处理均能降低Keap1和缺氧诱导因子-1α(Hif-1α)的表达,同时上调Nrf-2及其下游血红素加氧酶-1(HO-1)的水平。当使用Nrf-2特异性抑制剂ML385或siRNA敲低Nrf-2时,KAR的保护作用被显著削弱,这直接证明了Keap1/Nrf-2通路的核心地位。
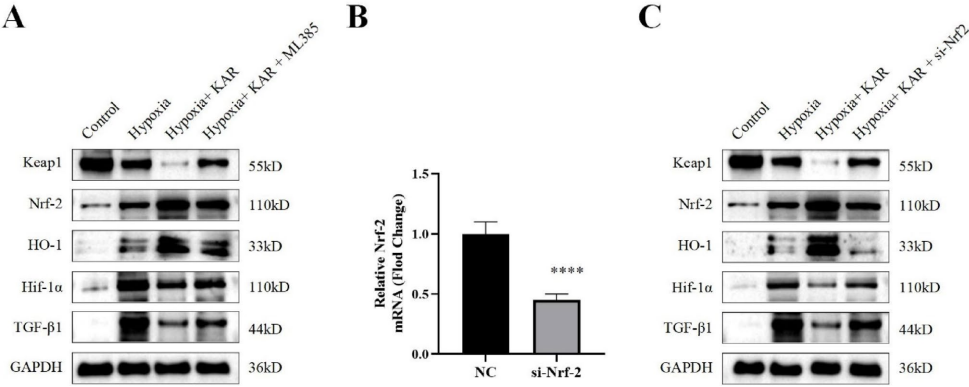
这项研究首次系统阐明了苦参酮对抗肾纤维化的双重机制:一方面通过抑制促纤维化的TGF-β1/Smad3轴,另一方面通过激活保护性的Keap1/Nrf-2通路,同时还能调节巨噬细胞向抗炎的M2型极化。这种多靶点作用特点使其相比现有单靶点药物更具治疗优势。从转化医学角度看,该研究不仅为开发新型抗纤维化药物提供了候选分子,还为理解天然产物的多靶点作用模式提供了范例。值得一提的是,KAR作为传统中药成分,其安全性已有一定基础,这将大大加速其临床转化进程。未来研究可进一步探索KAR在其他器官纤维化中的应用,以及与其他抗纤维化药物的协同效应。
 生物通微信公众号
生物通微信公众号
知名企业招聘