
-

生物通官微
陪你抓住生命科技
跳动的脉搏
肺癌组织内细菌的分离培养与体外功能验证:揭示肿瘤微环境中微生物促癌机制
【字体: 大 中 小 】 时间:2025年08月30日 来源:BMC Microbiology 4.2
编辑推荐:
本研究针对肺癌组织中微生物群落的功能机制这一科学问题,通过培养组学(culturomics)和16S rDNA测序技术,从18例非小细胞肺癌(NSCLC)患者组织中分离出12种细菌(以葡萄球菌属为主)。体外实验证实,这些菌株通过分泌热敏感蛋白成分显著促进A549细胞增殖,并诱导THP-1巨噬细胞释放TNF-α、IL-1β等促炎因子,为肺癌微环境中菌群-免疫-肿瘤互作机制提供了直接证据。发表于《BMC Microbiology》的这项研究首次实现肺癌组织菌株的功能验证,为靶向肿瘤微生物的干预策略奠定基础。
肺癌与微生物的隐秘对话
长久以来,肺部被视为无菌环境,但近年研究发现肺癌组织中存在独特的微生物群落。这些"肿瘤居民"如何影响癌症进展?是偶然的"过客"还是推动肿瘤发展的"帮凶"?这些问题成为癌症研究的新热点。尽管测序技术揭示了肺癌微生物组的组成变化,但活菌分离和功能验证始终是领域瓶颈。由Yifan Sun、Ruifu Yang等团队发表在《BMC Microbiology》的研究,首次通过多组学联用破解了这一难题。
关键技术方法
研究团队从北京肿瘤医院收集18例未经治疗的NSCLC患者手术标本(13例腺癌,5例鳞癌),同步采用培养组学(模拟多种生理条件的培养技术)和16S rDNA V3-V4区测序分析。从阳性培养样本中筛选4株临床分离的葡萄球菌(S. warneri-01等),通过实时细胞分析(RTCA)检测A549细胞增殖,ELISA定量THP-1巨噬细胞分泌的TNF-α、IL-1β、IL-6水平,并采用热处理实验区分蛋白与非蛋白成分的功能差异。
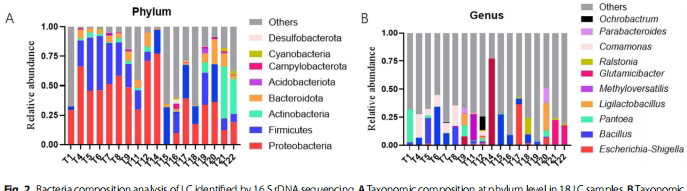
微生物群落图谱
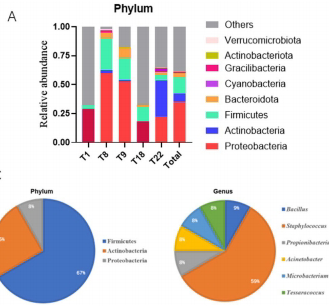
通过16S测序发现,肺癌组织优势菌门为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和放线菌门(Actinobacteriota),但个体差异显著。培养组学则从5例样本分离出12株菌,其中67%属于厚壁菌门,葡萄球菌属(Staphylococcus)占比达59%。值得注意的是,仅芽孢杆菌属(Bacillus)能被两种方法共同检出,提示多数肺癌相关微生物难以通过常规培养获得。
厌氧环境的生存优势
培养条件对比显示,85.7%的分离菌在厌氧条件下生长更佳,包括临床罕见的Tessaracoccus属。这一现象与肺癌组织特有的缺氧微环境高度契合,暗示微生物可能通过适应低氧压力获得生存优势。
功能验证突破
体外实验显示,四株葡萄球菌培养上清使A549细胞增殖率提升2.1-3.8倍(p<0.01)。THP-1巨噬细胞接触菌体成分后,TNF-α分泌量激增4-7倍,IL-1β升高3-5倍(p<0.001)。其中S. capitis-22表现最强促炎效应,热处理使其促炎活性降低62%,证实热不稳定蛋白组分是关键效应分子。
临床转化的启示
该研究首次建立从肺癌组织分离功能菌株的技术流程,证实肿瘤驻留菌可通过双重机制促进癌症发展:直接刺激肿瘤细胞增殖,间接激活巨噬细胞释放促炎因子形成慢性炎症微环境。特别值得注意的是,S. nepalensis(此前仅在特发性肺纤维化中发现)的致癌作用提示微生物可能具有跨疾病的病理机制。尽管样本量限制需扩大验证,但这项研究为开发微生物标志物和靶向干预策略提供了实验基础,未来或可通过调节肿瘤微环境菌群实现"以菌治癌"的新疗法。
 生物通微信公众号
生物通微信公众号
知名企业招聘