
-

生物通官微
陪你抓住生命科技
跳动的脉搏
CRISPR/dCas9-TET1表观遗传编辑靶向激活miR-200c:逆转乳腺癌EMT进程的创新策略
【字体: 大 中 小 】 时间:2025年08月29日 来源:Scientific Reports 3.9
编辑推荐:
为解决乳腺癌中肿瘤抑制性miR-200c因启动子甲基化沉默导致的EMT(上皮-间质转化)失调问题,研究人员通过CRISPR/dCas9-TET1系统靶向编辑miR-200c启动子甲基化状态。结果表明,双gRNA协同作用可显著上调miR-200c表达,抑制ZEB1/ZEB2-KRAS通路并逆转EMT表型,为乳腺癌靶向表观治疗提供新思路。
研究背景
乳腺癌作为女性最高发的恶性肿瘤,其转移和耐药问题长期困扰临床治疗。表观遗传学研究发现,microRNA-200c(miR-200c)的启动子异常甲基化会导致这个关键肿瘤抑制因子的沉默,进而解除其对上皮-间质转化(Epithelial-Mesenchymal Transition, EMT)的抑制作用。传统DNA甲基转移酶抑制剂(DNMTis)因缺乏靶向性易引发全局表观紊乱,而CRISPR/dCas9-TET1系统通过融合失活Cas9(dCas9)与TET1去甲基化酶,可实现特定基因位点的精准表观编辑。这项发表于《Scientific Reports》的研究,首次将该技术应用于miR-200c的靶向激活,为逆转乳腺癌恶性表型提供了新范式。
关键技术方法
研究采用CRISPR/dCas9-TET1系统,设计两条靶向miR-200c启动子CpG岛的gRNA(gRNA1/gRNA2),通过HRM(高分辨率熔解曲线)分析甲基化水平,qPCR检测miR-200c及其下游靶基因表达,MTT法和流式细胞术评估细胞活力与凋亡。实验选用甲基化程度差异的MCF-7(低甲基化)和MDA-MB-231(高甲基化)乳腺癌细胞系进行对比。
研究结果
质粒构建验证
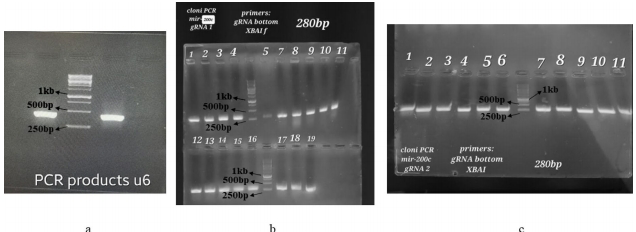
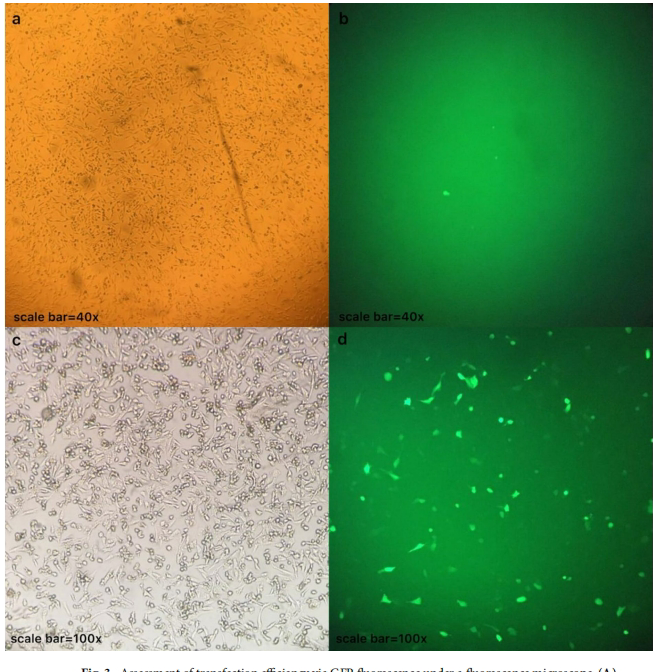
通过电泳和Sanger测序确认U6启动子片段(484 bp)和gRNA插入(280 bp)的正确性(图1)。转染效率经GFP荧光显微镜验证达80%以上(图3)。
miR-200c表观激活
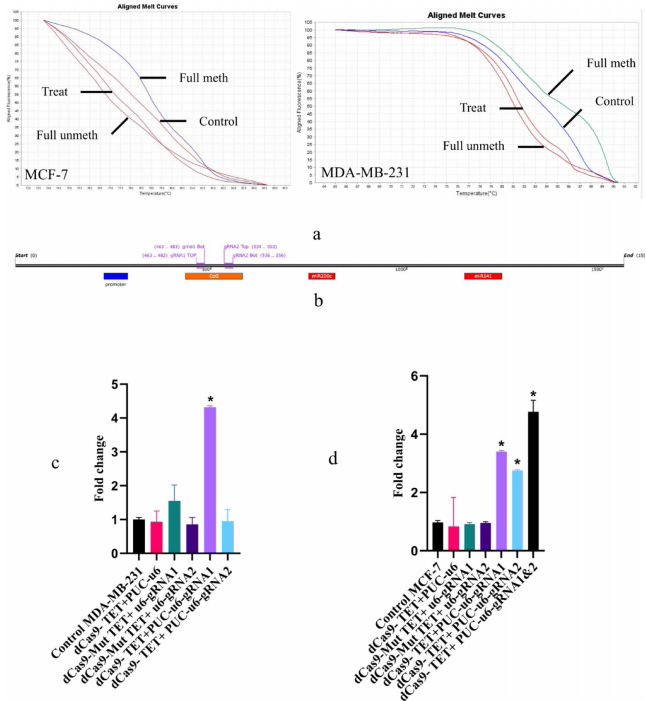
HRM分析显示dCas9-TET1显著降低启动子甲基化(图4A),在MDA-MB-231中gRNA1单用即可使miR-200c表达提升5倍,而MCF-7需双gRNA协同(图4C-D)。
EMT通路调控
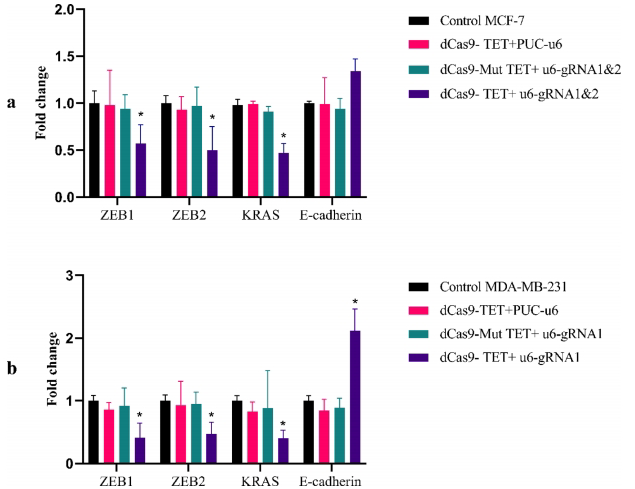
miR-200c上调导致ZEB1/ZEB2表达下降60-80%(图5),MDA-MB-231中E-cadherin恢复明显,但MCF-7变化微弱,提示表型转换存在细胞特异性。
功能学验证
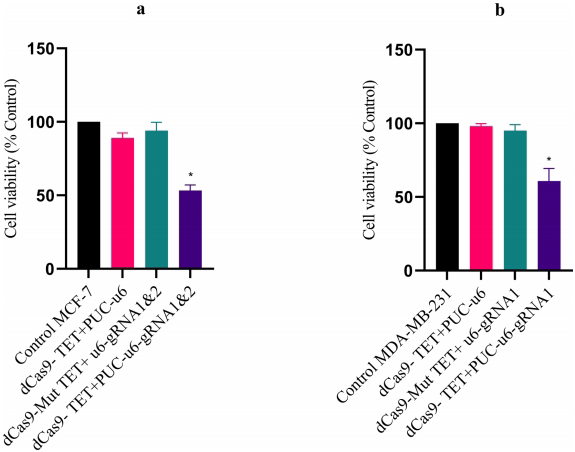
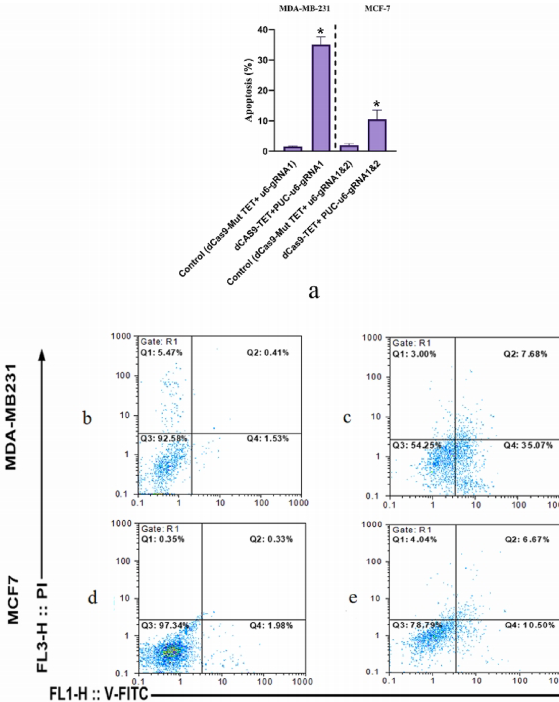
MTT显示双gRNA处理使MCF-7活力降低40%(图6A),MDA-MB-231凋亡率升至35.07%(图7B-C),证实表观编辑的抗肿瘤效应。
结论与意义
该研究首次证实CRISPR/dCas9-TET1可通过靶向编辑关键CpG位点逆转miR-200c沉默,其效应强度与细胞初始甲基化状态相关。值得注意的是,即使MCF-7启动子仅部分甲基化,局部去甲基化仍能显著激活基因表达,提示"表观热点"的存在。这种精准表观调控策略避免了DNMTis的脱靶效应,为开发基于miRNA的乳腺癌靶向疗法奠定基础。未来需进一步解析不同乳腺癌亚型中miR-200c下游网络的异质性,以优化治疗窗口。
 生物通微信公众号
生物通微信公众号
知名企业招聘