
-

生物通官微
陪你抓住生命科技
跳动的脉搏
荧光蛋白标记揭示线虫凋亡核心蛋白CED-9 Bcl-2、CED-4 Apaf1与CED-3 Caspase在非凋亡与凋亡细胞中的线粒体定位
【字体: 大 中 小 】 时间:2025年08月29日 来源:CELL DEATH AND DIFFERENTIATION 15.4
编辑推荐:
本研究通过CRISPR-Cas技术对线虫凋亡通路核心基因ced-9、ced-4和ced-3进行内源性mNeonGreen荧光标记,首次在活体胚胎中系统解析了CED-9 Bcl-2、CED-4 Apaf1和CED-3 Caspase的亚细胞分布动态。研究发现三者均定位于线粒体,其中CED-4呈现4倍富集的核周倾向性 puncta,而CED-3的线粒体定位独立于CED-9/CED-4。该成果修正了经典凋亡启动模型,为理解BCL-2家族蛋白调控机制提供了新视角。
程序性细胞死亡是动物发育过程中清除冗余细胞的保守机制。尽管线虫凋亡通路的核心组分CED-9 Bcl-2、CED-4 Apaf1和CED-3 Caspase已被鉴定数十年,但其内源性蛋白的时空分布仍存在争议。传统模型认为CED-9通过将CED-4锚定在线粒体外膜抑制凋亡,而EGL-1激活后触发CED-4核周聚集形成凋亡小体。然而,多个实验室对CED-4的核周转位假说提出质疑,且CED-3的亚细胞定位尚未在体细胞中系统研究。
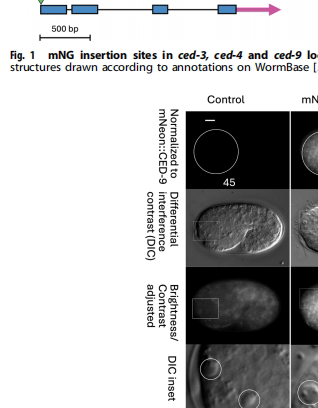
为破解这些争议,Barbara Conradt团队在《CELL DEATH AND DIFFERENTIATION》发表研究,首次实现活体胚胎中凋亡核心蛋白的内源性荧光标记。通过CRISPR-Cas9/12介导的基因组编辑,研究人员在ced-9 N端、ced-4和ced-3 C端插入mNeonGreen序列,获得功能近乎完整的标记株系。结合TMRE线粒体染色和超分辨成像技术,发现:
CRISPR-Cas标记策略验证功能性
测序证实所有标记位点准确插入,表型分析显示标记株系凋亡细胞数量与野生型相近。其中ced-3::mNG虽表现出轻微功能减弱(前咽额外细胞0.3个),但整体验证了标记系统的可靠性。
线粒体共定位的普适性特征
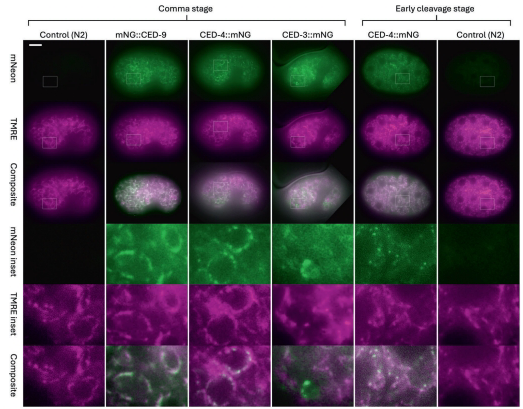
超分辨成像显示:mNG::CED-9与TMRE信号高度重叠(Pearson系数0.815),证实其均匀分布于线粒体外膜;CED-4::mNG虽整体定位于线粒体(PC=0.53),但呈现周期性4倍富集的 puncta,在胚胎后期倾向于核周取向;CED-3::mNG同样显示线粒体关联(PC=0.703),且在凋亡细胞中信号增强。
RID谱系中的动态变化
通过unc-3启动子驱动的核标记追踪发现:CED-3::mNG在注定凋亡的RID姐妹细胞中特异性增强,而CED-9和CED-4的分布无显著改变,提示CED-3的积累可能是凋亡执行的早期事件。
CED-4重分布的调控机制
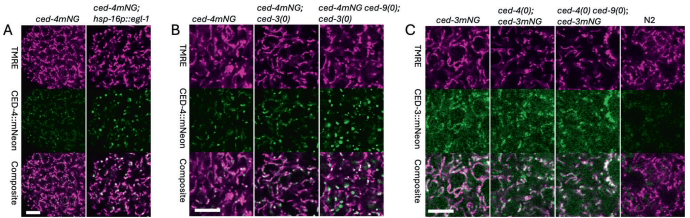
当通过热休克过表达egl-1或敲除ced-9时,CED-4::mNG从线粒体全长分布转变为集中富集于 puncta,信号强度提升2倍。值得注意的是,这种重分布仍保持线粒体关联性,且ced-3突变背景下的ced-9敲除导致 puncta进一步增大。
CED-3定位的独立性
在ced-4或ced-9单/双突变体中,CED-3::mNG的线粒体定位均未受影响。生物信息学分析揭示CED-3含多个内部线粒体靶向序列,可能通过TOM-20/70直接锚定在线粒体。
研究最终提出修正模型:在非凋亡细胞中,CED-9以2:1摩尔比结合CED-4二聚体并分散于线粒体,同时抑制CED-4寡聚化为不完整凋亡小体(hexamer/heptamer);当EGL-1被诱导后,通过解除CED-9抑制促使凋亡小体成熟,但该过程始终在线粒体表面完成。该发现颠覆了CED-4核周转位的传统认知,为BCL-2家族蛋白的时空调控机制提供了新范式。
关键技术方法包括:1) CRISPR-Cas9/12介导的内源性基因mNeonGreen标记;2) TMRE活体线粒体染色与超分辨共定位分析(Zeiss LSM 980 AiryScan 2);3) 热休克诱导的egl-1过表达系统;4) 基于unc-3启动子的RID谱系追踪;5) 前咽额外细胞计数的表型定量。
 生物通微信公众号
生物通微信公众号
知名企业招聘