
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:探索铁死亡在食管癌中的作用:机制与治疗意义
【字体: 大 中 小 】 时间:2025年08月27日 来源:Cell Death Discovery 7
编辑推荐:
这篇综述系统阐述了铁死亡(ferroptosis)在食管癌(EC)中的分子机制与治疗潜力。文章聚焦铁死亡的关键调控因子GPX4、NRF2和SLC7A11等靶点,揭示了其在肿瘤微环境(TME)重塑、代谢重编程及联合放化疗/免疫治疗中的协同作用,为克服EC治疗耐药性提供了新策略。
铁死亡是一种铁依赖性脂质过氧化驱动的程序性细胞死亡方式,其核心特征包括谷胱甘肽(GSH)耗竭、GPX4活性抑制以及活性氧(ROS)累积。这种独特的死亡模式与凋亡、坏死等传统途径截然不同,为肿瘤治疗提供了全新视角。
铁代谢失衡是铁死亡的关键触发因素。转铁蛋白受体(TFRC)介导的铁摄取、铁蛋白自噬以及铁转运蛋白(SLC40A1)共同调控细胞内游离铁池(LIP)水平。当铁超载时,通过芬顿反应催化脂质过氧化物(LOOH)转化为毒性自由基,导致细胞膜破裂。
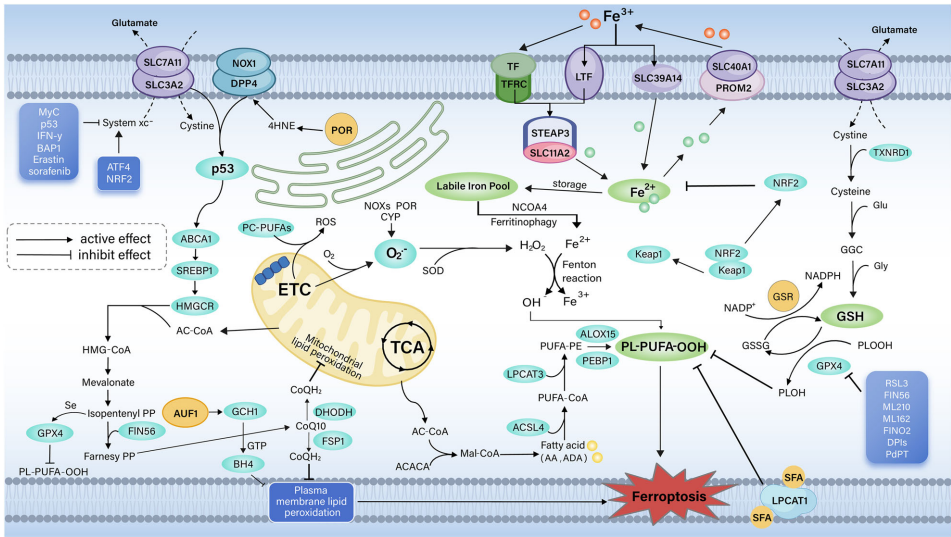
抗氧化系统是抵抗铁死亡的重要屏障。GPX4依赖的谷胱甘肽通路通过还原脂质过氧化物维持细胞稳态,而FSP1-CoQ10和GCH1-BH4通路则构成GPX4非依赖性的“备份防御”。值得注意的是,NRF2作为氧化应激的核心转录因子,通过调控SLC7A11、HO-1等靶基因双向调节铁死亡敏感性。
食管鳞癌(ESCC)和腺癌(EAC)均表现出显著的铁死亡相关基因(FRG)表达异常。临床数据显示,GPX4高表达与EC不良预后相关,而抑制GPX4可通过RSL3、erastin等诱导剂显著增强癌细胞对放化疗的敏感性。
肿瘤微环境中的免疫细胞与铁死亡存在复杂互作:CD8+T细胞通过分泌IFN-γ抑制SLC7A11,促进肿瘤细胞铁死亡;而TAM(肿瘤相关巨噬细胞)极化状态直接影响其对铁死亡的抵抗能力。代谢重编程同样关键——缺氧诱导因子HIF-1α通过上调LDH和SLC7A11促进EC细胞耐药,而靶向SCD1可逆转这一过程。
联合治疗展现出巨大潜力:
靶向干预:奥利迪宁(oridonin)通过γ-谷氨酰循环诱导铁死亡;布鲁萨托(brusatol)抑制NRF2通路增强顺铂疗效
免疫协同:PD-1抑制剂与铁死亡诱导剂联用可激活免疫原性细胞死亡(ICD)
纳米技术:基于CeO2纳米颗粒的递送系统可精准调控铁死亡阈值
预后模型研究筛选出ALOX12、SLC38A1等关键FRG,其表达谱可预测EC患者免疫治疗响应。未来需进一步探索组织特异性递送系统和生物标志物优化,以实现铁死亡疗法的精准临床应用。
 生物通微信公众号
生物通微信公众号
知名企业招聘