
-

生物通官微
陪你抓住生命科技
跳动的脉搏
线粒体氧化磷酸化与嘧啶合成通路调控蛋白激酶A活性的全基因组RNAi筛选研究
【字体: 大 中 小 】 时间:2025年08月27日 来源:Communications Biology 5.1
编辑推荐:
本研究通过构建活体PKA(蛋白激酶A)荧光传感器,在秀丽隐杆线虫肠道中开展全基因组RNAi筛选,首次系统鉴定了肠道PKA活性的自主与非自主调控网络。研究发现抑制线粒体OXPHOS(氧化磷酸化)通路和嘧啶合成途径可显著激活PKA,后者通过不依赖cAMP的新机制发挥作用。该成果为代谢性疾病和癌症等PKA相关疾病的治疗提供了新靶点,发表于《Communications Biology》。
蛋白激酶A(PKA)作为细胞信号转导的核心调控分子,在代谢、细胞分化和寿命调控中发挥关键作用。然而,组织层面调控PKA活性的复杂网络仍存在大量未知。特别是在肠道等代谢活跃组织中,PKA如何响应不同生理病理刺激的机制尚不明确。这一知识缺口严重限制了针对PKA异常激活相关疾病(如代谢综合征、神经退行性疾病和癌症)的治疗策略开发。
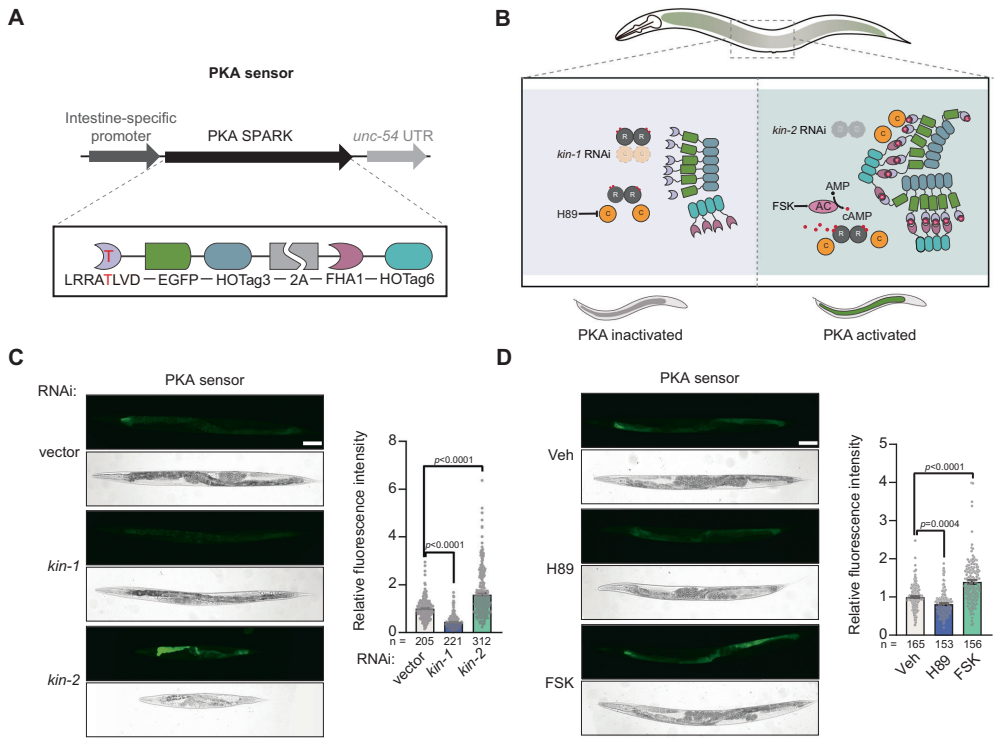
为解决这一科学问题,Yanjie Li、Duo Duan等研究团队在《Communications Biology》发表创新性研究。他们巧妙地将相位分离原理构建的PKA-SPARK生物传感器引入线虫肠道,通过ges-1启动子实现组织特异性表达。该传感器通过LRRATLVD基序磷酸化触发FHA1结构域结合,进而形成EGFP凝聚体放大荧光信号,首次实现活体动物PKA活性的实时动态监测。
研究采用三大关键技术:1)基于相位分离原理的活体PKA传感器构建技术;2)覆盖90%基因组的全基因组RNAi筛选与肠道特异性RNAi筛选相结合的遗传学策略;3)LC-MS/MS检测cAMP水平与CRISPR-Cas9基因编辑验证跨物种保守性。通过建立SJ4143对照株排除启动子干扰,研究者系统鉴定了722个PKA抑制因子和79个激活因子。
线粒体OXPHOS通路抑制激活PKA
研究发现抑制线粒体复合体I(nuo-1)、III(cyc-1)或ATP合酶(R53.4)基因表达,或使用鱼藤酮处理,均显著增强肠道PKA活性。这与哺乳动物中活性氧(ROS)通过氧化PKA调节亚基(PKA-R)激活PKA的报道相呼应,提示OXPHOS-PKA调控通路的进化保守性。
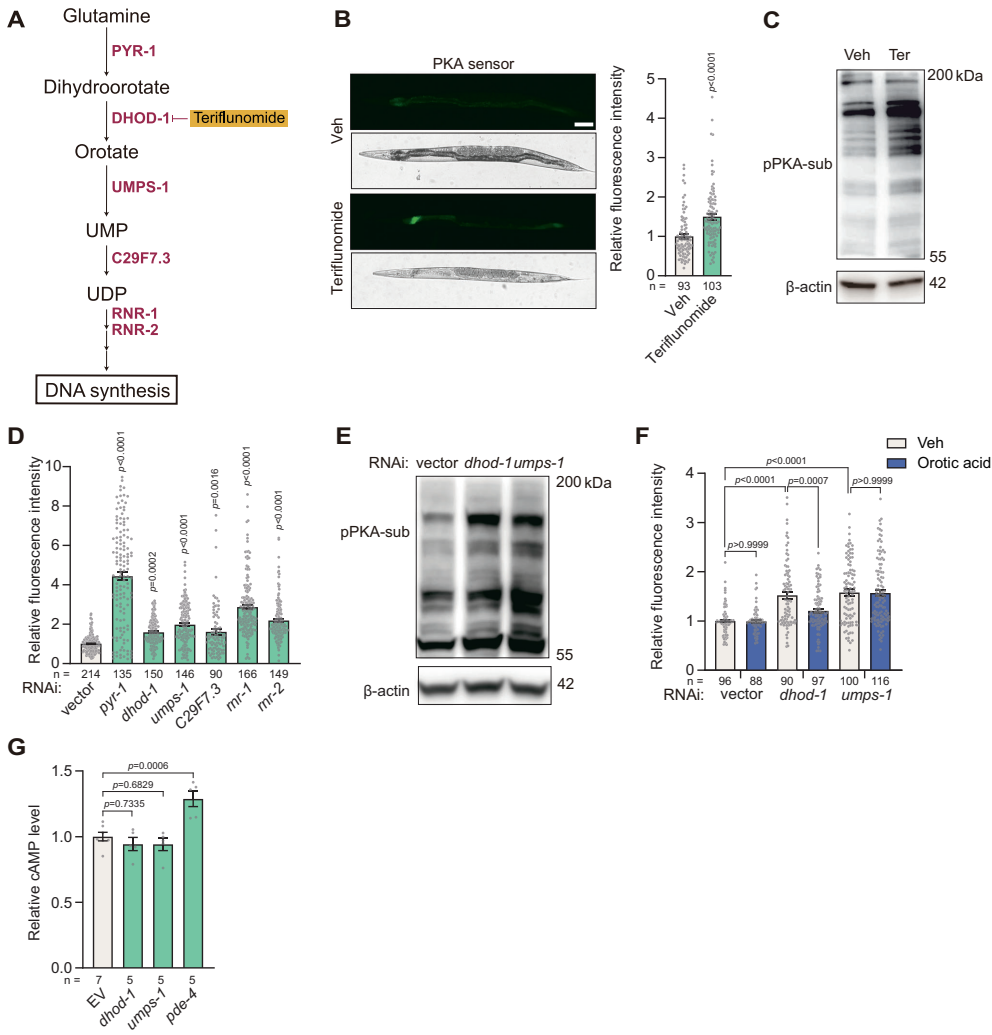
嘧啶合成途径的cAMP非依赖调控
全基因组筛选发现dhod-1(二氢乳清酸脱氢酶)、umps-1(尿苷酸合成酶)等嘧啶合成关键基因的RNAi可显著激活PKA。使用DHODH特异性抑制剂特立氟胺处理重现该效应,而补充代谢产物乳清酸可逆转dhod-1 RNAi的影响。LC-MS/MS分析证实该调控不依赖cAMP水平变化,揭示全新的代谢物-PKA直接调控轴。
跨物种保守性验证
在人类293T细胞中,CRISPR敲除DHODH或特立氟胺处理均增加PKA底物CREB磷酸化,且乳清酸补充可逆转该效应,证实嘧啶代谢-PKA调控通路的进化保守性。
该研究首次绘制了肠道PKA活性的空间调控网络,发现线粒体能量代谢与嘧啶合成两条全新调控通路。特别值得注意的是,嘧啶合成通路通过代谢物直接调控PKA活性的发现,为理解代谢异常相关疾病中PKA失调提供了新视角。临床方面,研究提示FDA批准的特立氟胺可能通过意外激活PKA产生副作用,而乳清酸补充或成为潜在干预策略。技术层面,开发的活体PKA传感器为研究激酶动态调控提供了强大工具,其高频脉冲式信号响应特征为揭示PKA信号时空动力学开辟了新途径。
这些发现不仅深化了对PKA调控网络的理解,更为代谢性疾病、神经退行性疾病和癌症等PKA相关疾病的治疗提供了多个可干预的新靶点。未来研究可进一步探索嘧啶代谢物如何直接调控PKA活性,以及组织间PKA调控网络的交互作用,为精准医疗提供理论基础。
 生物通微信公众号
生物通微信公众号
知名企业招聘