
-

生物通官微
陪你抓住生命科技
跳动的脉搏
心血管疾病基因治疗新策略:从基因编辑到再生医学的突破性进展
【字体: 大 中 小 】 时间:2025年08月26日 来源:Cardiovascular Research 13.3
编辑推荐:
本研究针对心血管基因治疗领域的技术瓶颈,系统综述了AAV(腺相关病毒)载体递送、CRISPR-Cas9基因编辑和心肌再生等前沿技术在治疗遗传性心肌病(如Danon病、ARVC)和常见心血管疾病(如心衰HFrEF/HFpEF)中的应用。研究揭示了SERCA2a钙循环调控、LAMP2B自噬修复等关键靶点的临床转化价值,为开发首个获批心血管基因疗法提供了10年发展路线图。
心血管疾病长期占据全球死亡原因首位,传统药物治疗在遗传性心肌病和终末期心衰面前往往束手无策。尽管基因治疗在血友病、眼科疾病等领域已取得突破,但心血管系统因其特殊的解剖生理特点,始终未能迎来首个获批的基因疗法。这种困境主要源于三大技术瓶颈:递送系统的心脏靶向性不足、基因编辑工具的体内安全性存疑,以及临床转化路径不明朗。
为突破这些限制,Patricia L. Musolino等国际权威专家在《Cardiovascular Research》发表重磅综述,系统梳理了心血管基因治疗从实验室到临床的转化路径。研究团队采用多中心协作模式,整合了英国爱丁堡大学、哈佛医学院等10余家顶尖机构的最新成果。关键技术包括:新型AAV2i8载体心脏靶向递送、CRISPR-Cas9碱基编辑(ABE)技术纠正MYH7突变、腺病毒介导的TIMP-3血管保护策略,以及基于MHCK7启动子的组织特异性表达调控。
在"基因治疗靶向心肌"章节,研究详细分析了当前临床进展:AAV1.SERCA2a治疗心衰的MUSIC-HFrEF试验虽未达主要终点,但为剂量优化提供了关键数据;静脉注射AAV9.LAMP2B治疗Danon病的试验显示左室质量指数改善,成为首个采用替代终点的关键性试验。值得注意的是,采用机械循环支持(如Impella)可使猪模型中心肌AAV摄取提升106倍,这为临床给药方案优化提供了新思路。
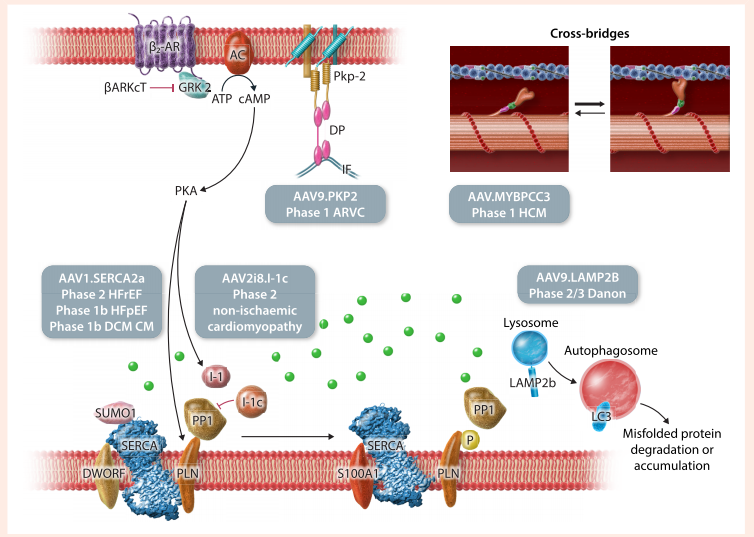
"靶向心脏再生"部分揭示了miRNA调控的突破性发现:AAV6-miR-199a虽能在小鼠心梗模型中促进心肌细胞增殖,但在猪模型中却导致过度增殖不良反应,凸显精准调控表达的重要性。研究人员特别强调,未来再生策略需协同调控Hippo-YAP通路、细胞周期因子(如cyclin A2)和血管淋巴管生成的三重机制。
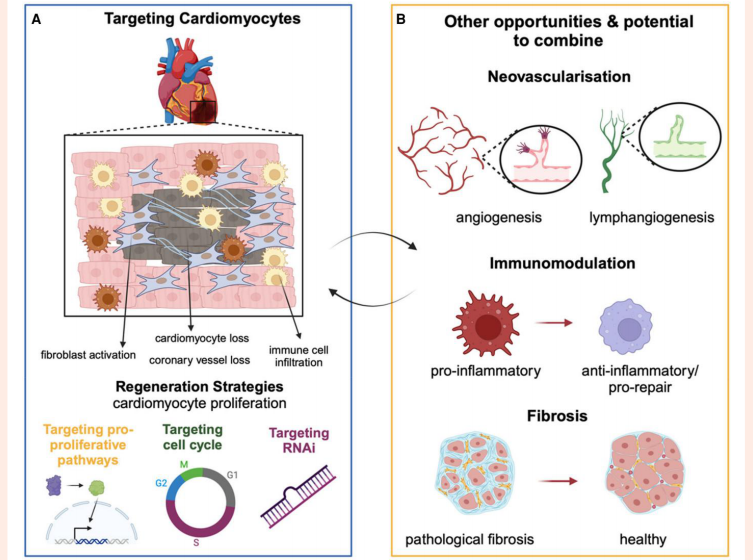
"血管疾病基因治疗"章节重点介绍了PROTECT试验的创新设计:在冠状动脉搭桥术中,采用腺病毒载体对自体大隐静脉进行TIMP-3基因修饰,这种离体(ex vivo)策略既可避免全身暴露,又能有效抑制移植静脉的基质金属蛋白酶活性。首个受试者已在该试验中完成治疗,为血管再狭窄提供了全新解决方案。
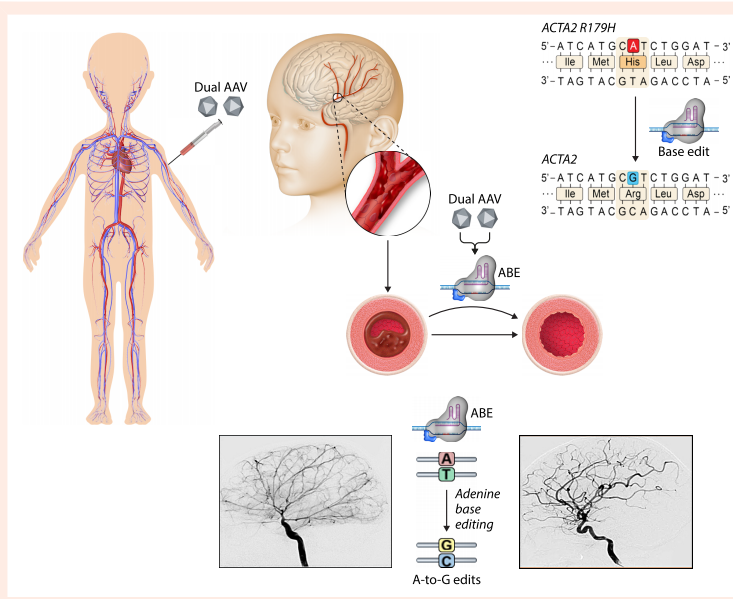
"基因编辑技术"部分详细阐述了CRISPR-Cas9系统的最新进展:双AAV9递送的ABE成功纠正mdx小鼠的dystrophin基因突变,编辑效率达90%以上;而GalNAc-LNP递送系统则实现了肝脏PCSK9的高效敲除,为家族性高胆固醇血症治疗开辟新途径。特别值得注意的是,针对ACTA2相关血管病的新型碱基编辑器,通过精确定位R179H突变位点,为多系统平滑肌功能障碍综合征提供了首个基因治疗方案。
在"调控治疗基因表达"章节,研究比较了Tet-OFF系统与核糖开关的优劣:合成启动子通过组合H3K27乙酰化标记的增强子元件,使心肌特异性表达提高8倍;而aptazyme(适配体-核酶)开关则可通过小分子精确调控转基因表达时长,这对再生疗法尤为重要。
这项研究的重要意义在于:首次构建了心血管基因治疗的完整发展框架,明确了未来十年重点突破方向。通过建立国际协作网络(如REACT研究中心),整合学术界、临床机构、产业界和监管部门的资源,加速了从基础发现到临床转化的进程。特别在安全性方面提出的"双重验证"原则——即同时检测on-target编辑效率和off-target效应,为监管审批提供了关键标准。随着MUSIC-DMD等关键试验数据的陆续公布,首个心血管基因疗法有望在2030年前获批上市,这将彻底改变遗传性心肌病和终末期心衰的治疗格局。
 生物通微信公众号
生物通微信公众号
知名企业招聘