
-

生物通官微
陪你抓住生命科技
跳动的脉搏
多顺式调控模块协同确保Tup/Islet1在果蝇背肌身份决定中的稳健功能
【字体: 大 中 小 】 时间:2025年08月26日 来源:Skeletal Muscle 4.4
编辑推荐:
本研究针对果蝇肌肉发育中关键转录因子Tup/Islet1的调控机制,通过CRISPR-Cas9基因编辑和转录分析技术,首次揭示三个顺式调控模块(CRMs)通过时空接力方式精确调控tup表达的模式。研究发现tupF4、tupADME和tupHDME三个增强子分别负责启动、维持和放大tup在背肌中的表达,其中后两者通过Tup自调控机制实现功能冗余,确保肌肉形态正确发育。该成果发表于《Skeletal Muscle》,为理解多增强子协同调控发育关键基因提供了新模式。
在动物发育过程中,精确调控的肌肉模式形成是运动功能的基础。果蝇幼虫具有30个体节肌肉组成的精密运动系统,每个肌肉的独特形态由其"身份转录因子"(iTFs)的特异组合决定。其中LIM同源框转录因子Tup(脊椎动物Islet1的同源物)对背肌发育至关重要,但关于其表达调控机制仍存在三大谜团:多组织表达如何精确调控?不同肌肉谱系如何实现差异调控?以及为何敲除实验显示表型比预期轻微?
为解答这些问题,Aurore Pelletier团队在《Skeletal Muscle》发表研究,系统分析了tup基因上游26kb的调控区域。通过整合21个GMR-Gal4报告基因系的表达谱、染色质免疫沉淀数据和进化保守性分析,鉴定出三个关键顺式调控模块(CRMs):已知的tupF4和新发现的tupADME、tupHDME。研究采用CRISPR-Cas9介导的增强子删除、内含子探针原位杂交和肌肉特异性标记等技术,揭示了这些CRMs的时空活动规律。
技术方法上,研究首先通过生物信息学预测和报告基因筛选鉴定CRMs;利用CRISPR-Cas9构建单/双增强子缺失突变体;采用内含子探针区分内源与报告基因转录;结合免疫荧光和扫描电镜进行表型分析;所有果蝇品系来自Bloomington果蝇资源中心,突变体通过同源重组和PCR筛选获得。
【三个CRMs的时空特异性】研究发现tupF4在肌肉前体细胞阶段(胚胎10期)启动转录,tupHDME在祖细胞阶段(11期)激活,而tupADME在成肌细胞阶段(12期)才开始作用。到肌肉纤维延伸期(14-15期),tupF4活性下降,由tupADME和tupHDME维持表达。这种"接力式"调控确保tup在肌肉发育全程的稳定表达。
【组织特异性自调控机制】通过删除Tup结合位点实验证明,tupADME和tupHDME在背肌中依赖Tup自调控,但在心脏和淋巴腺中不依赖。特别值得注意的是,tupHDMEΔTup突变体在背肌完全失活,却保留心脏表达,显示组织特异性调控机制。
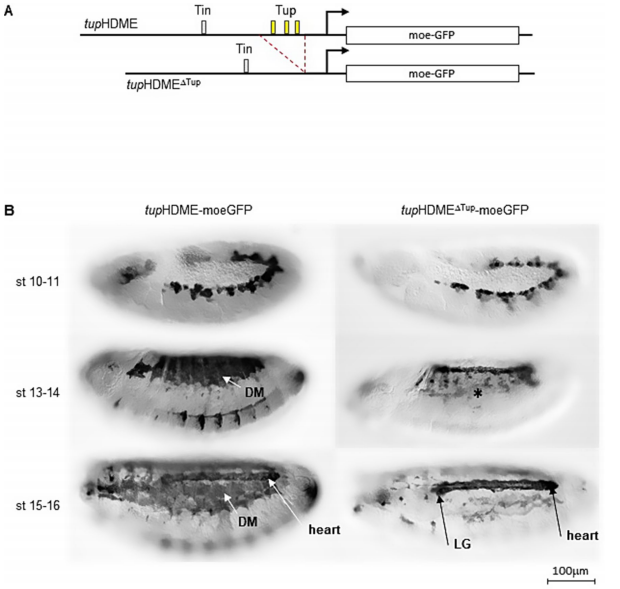
【增强子功能冗余性】单增强子缺失仅导致轻微表型,而双敲除tupADME+tupHDME则使晚期tup转录完全消失,导致61%的DA1和34%的DA2肌肉形态异常。扫描电镜显示幼虫期肌肉附着点错配,出现DA2/DA2同型连接(正常应为DA3/DA2异型连接),证实肌肉身份向DA3转化。
【发育生物学意义】该研究揭示多增强子通过三种机制确保发育稳健性:(1)时间接力(tupF4启动→tupHDME维持→tupADME放大);(2)空间互补(不同肌肉谱系使用不同增强子组合);(3)功能冗余(tupADME与tupHDME相互备份)。这种调控策略既能应对遗传噪声,又可灵活适应不同组织需求。
研究还提出"增强子接力"模型解释肌肉身份逐步决定过程:早期CRM(tupF4)响应位置信息启动表达;中期CRM(tupHDME)整合谱系信号;晚期CRM(tupADME)通过自调控锁定细胞命运。这种机制与另一关键因子Collier的调控模式相似,共同构成背肌模式形成的"双保险"。
该成果不仅阐明Tup/Islet1在进化保守的肌肉发育过程中的核心调控机制,更为理解复杂增强子网络如何协调发育程序提供范例。发现的增强子冗余原则可解释为何许多发育基因具有多个看似功能重复的调控元件,这对解读人类先天性肌病相关基因突变具有重要启示。
 生物通微信公众号
生物通微信公众号
知名企业招聘