
-

生物通官微
陪你抓住生命科技
跳动的脉搏
GATOR1-mTORC1通路缺失协同MYC过表达驱动淋巴瘤发生并揭示治疗新靶点
【字体: 大 中 小 】 时间:2025年08月22日 来源:Nature Communications 15.7
编辑推荐:
本研究针对MYC致癌基因在70%人类癌症中异常高表达但难以靶向治疗的难题,通过全基因组CRISPR/Cas9筛选发现GATOR1复合体(NPRL3/DEPDC5/NPRL2)是抑制MYC驱动淋巴瘤发生的关键负调控因子。研究人员利用Eμ-Myc转基因小鼠模型,揭示GATOR1缺失通过持续激活mTORC1信号通路,与MYC协同促进淋巴瘤发生,且该过程与p53突变互斥。更重要的是,GATOR1缺陷型淋巴瘤对mTOR抑制剂高度敏感,为MYC驱动肿瘤提供了精准治疗策略。该成果发表于《Nature Communications》,为代谢干预治疗血液肿瘤提供了理论依据。
在肿瘤研究领域,MYC基因如同一个"失控的引擎",在70%的人类癌症中异常高表达。这个转录因子调控着细胞周期、增殖、代谢等核心生命活动,但其蛋白结构的"不可成药性"使得靶向治疗举步维艰。更棘手的是,MYC驱动的肿瘤常伴随复杂的代偿机制,单一靶向策略往往收效甚微。在B细胞淋巴瘤中,MYC过表达虽能启动恶性转化,但需要其他基因突变"推波助澜"才能完成癌变过程。传统研究多聚焦于p53等经典抑癌基因,而对代谢调控通路在MYC致癌中的作用认识不足。
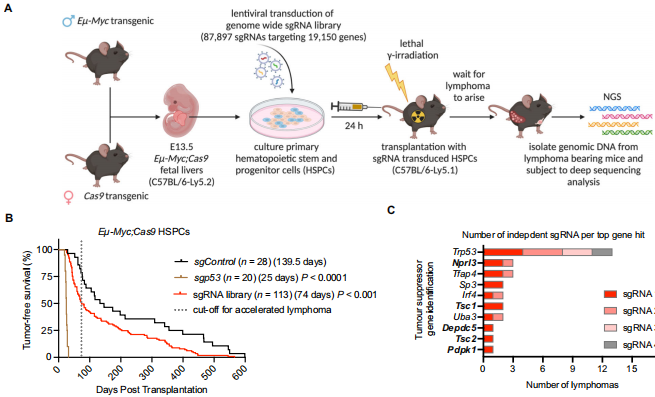
为系统揭示MYC驱动淋巴瘤的协同机制,研究人员设计了一项创新性的全基因组CRISPR/Cas9筛选。他们选择Eμ-Myc转基因小鼠模型——这是研究伯基特淋巴瘤(Burkitt Lymphoma)的金标准模型,其B细胞中持续高表达c-Myc会形成前白血病细胞池。通过将包含87,987条sgRNA的文库转导至胚胎肝造血干祖细胞(HSPCs),并移植至致死量辐照的受体小鼠,建立了一个模拟人类淋巴瘤发生全过程的活体筛选平台。这个设计的精妙之处在于:每个移植小鼠的淋巴瘤都是单克隆起源,只有最强效的抑癌基因缺失才能从数千个竞争者中"胜出"。
关键技术包括:1) 使用Eμ-Myc;Cas9双转基因小鼠的胚胎肝细胞进行全基因组CRISPR筛选;2) 移植至致死量辐照的C57BL/6-Ly5.1受体小鼠模拟肿瘤发生微环境;3) 对加速发生的淋巴瘤进行二代测序分析;4) 通过RNA-Seq和代谢分析解析mTORC1通路活性;5) 利用患者数据库验证临床相关性;6) 采用mTOR抑制剂进行体内外药效评估。人类样本分析基于9个B细胞淋巴瘤队列和TCGA数据库。
全基因组筛选发现mTOR抑制通路关键组分
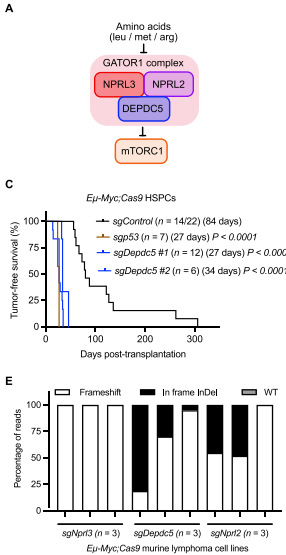
在59例加速发生的淋巴瘤中,测序分析不仅重现了已知的p53突变(13例淋巴瘤中检出4种不同sgRNA),更意外地发现GATOR1复合体的两个组分Nprl3和Depdc5成为显著富集的靶点。Nprl3的两个sgRNA在3例淋巴瘤中占主导,Depdc5的sgRNA也在1例中显著富集。这些基因与已知的mTOR负调控因子Tsc1、Tsc2和Pdpk1共同构成了筛选结果的顶级信号通路。值得注意的是,虽然Nprl2未被初始筛选捕获,但后续验证证实其缺失同样加速淋巴瘤发生,这与GATOR1复合体需要三个组分完整才能发挥功能的特性一致。
GATOR1缺失的生物学效应
通过构建特异性sgRNA的验证模型,研究发现Nprl3、Depdc5或Nprl2任一基因的缺失都能将淋巴瘤发生的中位时间从140天缩短至约25天,效果堪比p53缺失。机制研究表明,GATOR1缺陷导致mTORC1信号持续激活:在氨基酸充足时,缺陷型淋巴瘤细胞的磷酸化S6(p-S6)水平显著高于对照;而在氨基酸饥饿条件下,GATOR1缺陷细胞丧失了正常抑制mTORC1的能力。这种代谢失调表现为脂质合成增加、蛋白质翻译增强等特征,但不同于TSC2缺失模型的是,GATOR1缺陷并未显著影响MCL-1表达或凋亡敏感性。
临床相关性与治疗脆弱性
在人类弥漫大B细胞淋巴瘤(DLBCL)队列中,GATOR1低表达患者(任一组分mRNA表达处于最低四分位)的生存期显著缩短。更重要的是,73例患者测序显示DEPDC5/NPRL2突变与TP53突变存在显著互斥现象(p<0.0001),完美复现了小鼠模型的发现。治疗实验显示,GATOR1缺陷型淋巴瘤对mTOR抑制剂rapamycin和Torin1高度敏感——在体外实验中IC50降低5-10倍;在体内实验中,短期rapamycin治疗即可治愈大多数移植瘤模型,而对照淋巴瘤则完全无响应。
讨论与展望
这项研究通过创新的活体CRISPR筛选,揭示了氨基酸感应器GATOR1在抑制MYC驱动淋巴瘤中的核心作用。其科学价值体现在三个层面:首先,建立了GATOR1-mTORC1轴作为MYC协同致癌的新范式,补充了现有认知中TSC1/2-Rheb-mTORC1通路的主导地位;其次,发现代谢调控与基因组稳定性调控(p53通路)在淋巴瘤发生中的互斥关系,为肿瘤进化研究提供了新视角;最后,证实GATOR1缺陷造成的"代谢成瘾"可被mTOR抑制剂靶向,为MYC高表达肿瘤提供了可转化的精准治疗策略。
该研究的临床意义尤为突出:对于约占DLBCL患者25%的GATOR1低表达群体,mTOR抑制剂可能成为极具前景的单药治疗方案。未来研究可进一步探索GATOR1缺陷与其他致癌信号(如PI3K-AKT)的交互作用,以及在不同MYC表达水平肿瘤中的普适性。此外,开发针对GATOR1表达状态的诊断标志物,将有助于推动这一发现向临床转化。
 生物通微信公众号
生物通微信公众号
知名企业招聘