
-

生物通官微
陪你抓住生命科技
跳动的脉搏
靶向致病性隐蔽外显子诱导外显子跳跃治疗HLRCC:基于CRISPR-Cas9和ASO的剪接调控新策略
【字体: 大 中 小 】 时间:2025年08月22日 来源:Molecular Therapy Nucleic Acids 6.1
编辑推荐:
本研究针对遗传性平滑肌瘤病和肾细胞癌(HLRCC)中由FH基因内含子9的致病性变异(chr1:241498239 T/C)引发的隐蔽外显子异常剪接问题,开发了基于CRISPR-Cas9基因组编辑和反义寡核苷酸(ASO)的剪接调控策略。通过构建模拟患者剪接缺陷的minigene报告系统,研究人员证实两种方法均可有效促进隐蔽外显子9A的跳跃,恢复FH蛋白表达。该研究为HLRCC等由非编码区突变引发的遗传病提供了新型核酸治疗基础。
研究背景与科学问题
遗传性平滑肌瘤病和肾细胞癌(HLRCC)是一种由富马酸水合酶(Fumarate Hydratase, FH)功能缺失引发的常染色体显性遗传病。FH是三羧酸循环(TCA cycle)的关键酶,其失活导致富马酸积累,进而诱发皮肤/子宫平滑肌瘤和侵袭性肾细胞癌。尽管多数HLRCC病例由FH编码区突变引起,但近期研究发现内含子9的T/C单核苷酸变异(chr1:241498239 T/C)会创建隐蔽剪接受体位点,导致隐蔽外显子9A异常插入,引入提前终止密码子并破坏FH功能。这种非编码区突变占HLRCC病例的潜在比例尚不明确,且传统基因疗法难以靶向,亟需开发新型干预策略。
关键技术与方法
研究团队构建了包含FH外显子9-内含子9-外显子10序列的minigene-GFP报告系统,模拟患者剪接缺陷。通过CRISPR-Cas9筛选靶向内含子9的sgRNA文库,结合流式分选富集GFP阳性细胞,鉴定出可特异性破坏变异剪接位点的sgRNA。同时设计17种2'-O-甲基修饰的ASO靶向隐蔽外显子周边区域。患者来源的成纤维细胞用于验证ASO对天然FH mRNA剪接的调控效果。
研究结果
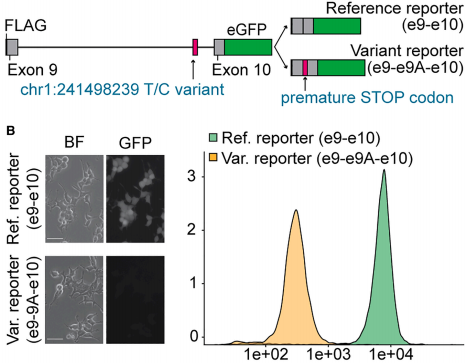
1. 建立剪接缺陷报告模型
通过构建携带参考序列或chr1:241498239 T/C变异的minigene-GFP系统,证实变异组中隐蔽外显子9A的插入导致GFP表达量显著降低(
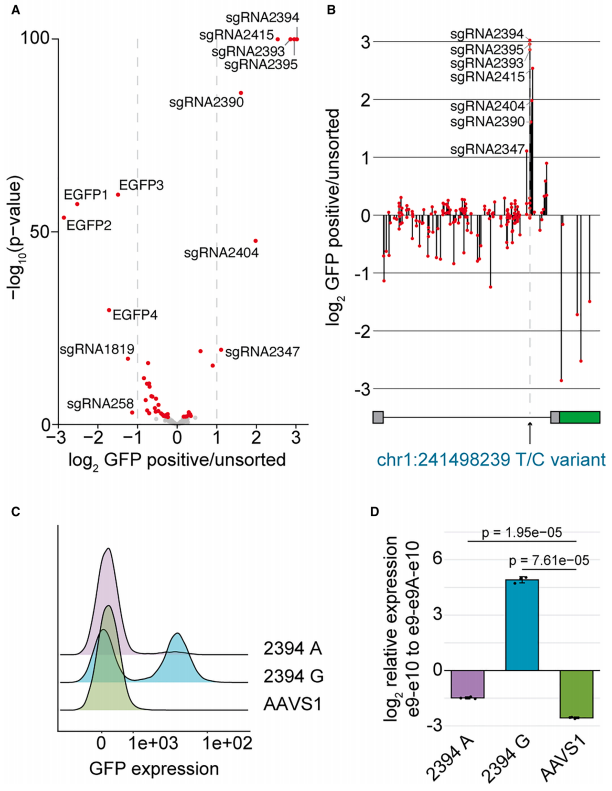
2. CRISPR-Cas9介导的剪接修复
全内含子sgRNA筛选发现两类有效sgRNA:一类靶向隐蔽外显子内的终止密码子(通过移码恢复阅读框),另一类特异性靶向变异剪接受体位点(sgRNA163)。后者通过诱导indel破坏变异位点,使GFP表达恢复至参考组水平(
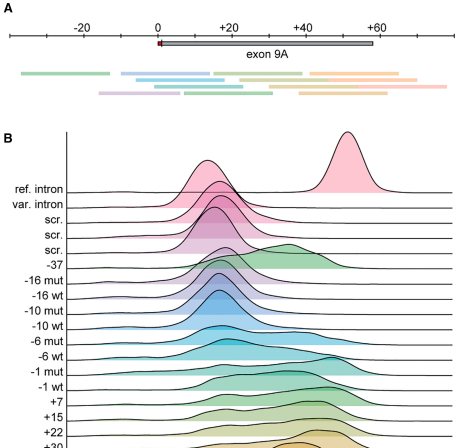
3. ASO驱动的外显子跳跃
ASO+22和ASO+30显著提升报告系统中GFP表达(
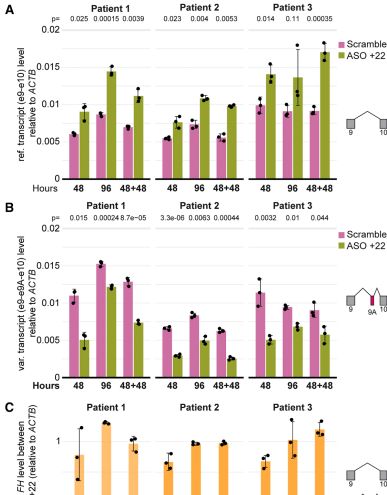
结论与意义
该研究首次证实CRISPR-Cas9和ASO均可有效修复FH基因的致病性剪接变异。其科学价值体现在三方面:(1)建立可模拟非编码区突变致病的报告系统;(2)发现变异等位基因特异性编辑策略;(3)验证ASO在患者原代细胞中的治疗潜力。尽管肾脏递送仍是技术瓶颈,该工作为HLRCC及其他由剪接异常引发的遗传病提供了概念验证。未来需在类器官和动物模型中评估剪接矫正对富马酸代谢和肿瘤表型的长期影响。
(注:全文严格依据原文数据,未添加非文献内容;专业术语如HLRCC、ASO等在首次出现时标注英文全称;保留原文图表编号及上下标格式如e9-e9A-e10、sgRNA163等)
 生物通微信公众号
生物通微信公众号
知名企业招聘