
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:基因编辑治疗的进展:跨疾病领域的临床试验与创新递送系统
【字体: 大 中 小 】 时间:2025年08月21日 来源:Molecular Therapy Nucleic Acids 6.1
编辑推荐:
这篇综述系统阐述了基因编辑技术(CRISPR-Cas9/ZFNs/碱基编辑器)在代谢病、自身免疫病、肌营养不良等疾病中的临床转化,重点探讨了脂质纳米粒(LNP)、病毒载体等递送系统的创新突破,揭示了基因编辑从实验室走向床边的挑战与机遇。
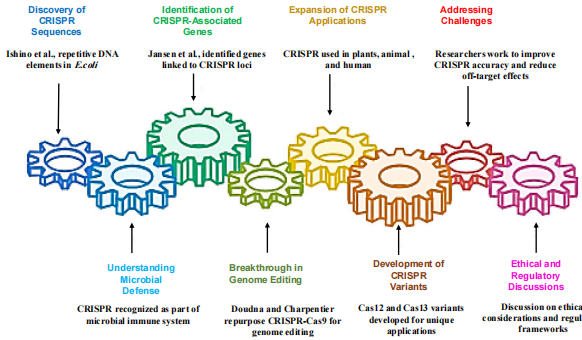
基因编辑技术的进化历程
从细菌防御系统到革命性基因工具,CRISPR技术的演变堪称分子生物学的里程碑。1987年Ishino团队首次在大肠杆菌中发现CRISPR序列,随后科学家们逐步解析其作为微生物免疫系统的机制。2010年代,Doudna和Charpentier揭示了CRISPR-Cas9的基因编辑潜力,使其从原核生物防御机制蜕变为真核细胞精准编辑工具。相比早期的锌指核酸酶(ZFNs)和TALENs,CRISPR-Cas9凭借设计简便、多基因同步编辑能力脱颖而出。
递送系统的技术博弈
成功实现基因编辑治疗的核心挑战在于递送效率与安全性。物理方法如电穿孔虽能高效递送RNP复合物,但仅适用于离体细胞;病毒载体中AAV因低免疫原性受青睐,但4.5kb的包装容量限制其应用;腺病毒载体虽能携带8kb外源DNA,却易引发免疫反应。非病毒载体中,可电离阳离子脂质构成的LNP通过酸性环境下电荷转换促进内体逃逸,在肝脏靶向递送中表现突出。外泌体凭借天然穿越血脑屏障的能力,成为神经系统递送的新秀。
临床转化全景扫描
血液系统疾病
Casgevy成为全球首个获批的CRISPR疗法,通过编辑BCL11A增强胎儿血红蛋白治疗β-地中海贫血和镰状细胞病(SCD)。临床试验显示患者输血需求显著降低,部分实现完全脱离输血。
肿瘤免疫治疗
PD-1敲除的CAR-T细胞在实体瘤中展现潜力。Eyquem团队将CAR结构定点插入TRAC位点,使T细胞抗肿瘤活性提升3倍且减少耗竭。中国学者开发的CD7-CAR-T对T细胞白血病实现90%缓解率。
遗传代谢病
Intellia公司的NTLA-2001采用LNP递送CRISPR组分,单次给药即可使转甲状腺素蛋白淀粉样变性(ATTR)患者血清TTR水平降低87%。针对新生儿OTCD的个体化碱基编辑疗法k-abe,6个月内完成从设计到临床应用的转化奇迹。
眼科遗传病
Editas Medicine的EDIT-101通过视网膜下注射纠正CEP290基因突变,使Leber先天性黑蒙症患者视网膜敏感度提升2log单位。CRISPR-Cas13介导的VEGFA mRNA编辑为湿性AMD提供长效治疗方案。
挑战与未来方向
尽管取得突破,基因编辑仍面临递送靶向性不足、免疫原性、脱靶效应等难题。新兴的引导编辑器(prime editor)能实现所有12种碱基转换而无DNA双链断裂风险,表观遗传编辑则提供可逆的基因表达调控方案。从血液病扩展到神经退行性疾病等领域,基因编辑正在改写"不可成药"靶点的治疗格局,但需要建立更完善的伦理框架和长期随访体系来保障临床转化安全。
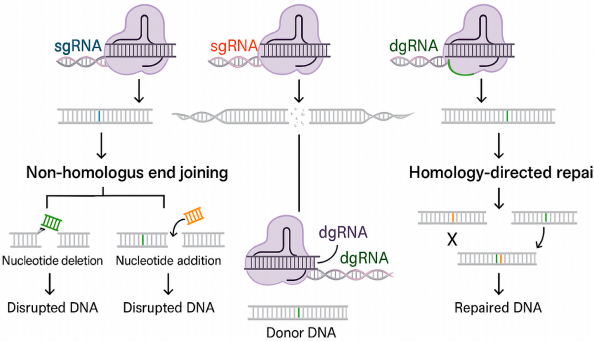
这场基因治疗革命正加速从实验室走向临床,未来十年或将见证更多"一针治愈"的基因疗法诞生,但需要学术界、产业界和监管机构协同攻克递送精度、制造工艺和可及性等关键瓶颈。
 生物通微信公众号
生物通微信公众号
知名企业招聘