
-

生物通官微
陪你抓住生命科技
跳动的脉搏
氧化磷酸化通路关键基因UQCRFS1调控CD8+TILs耗竭在弥漫大B细胞淋巴瘤中的机制及临床意义
【字体: 大 中 小 】 时间:2025年08月14日 来源:Biology Direct 4.9
编辑推荐:
本研究针对弥漫大B细胞淋巴瘤(DLBCL)中CD8+肿瘤浸润淋巴细胞(TILs)代谢重编程与免疫耗竭的关联机制这一关键科学问题,通过单细胞RNA测序(scRNA-seq)等技术,首次揭示OXPHOS(氧化磷酸化)通路基因UQCRFS1是CD8+TILs耗竭的关键标志物。研究发现高UQCRFS1表达与免疫抑制微环境、不良预后及免疫检查点阻断(ICB)治疗抵抗显著相关,并发现MYC信号和P2RY8突变可能参与调控。该成果为DLBCL免疫治疗提供了新靶点,发表于《Biology Direct》。
在肿瘤免疫治疗领域,CD8+T细胞就像战场上的"精疲力尽的士兵"——它们本应识别并消灭肿瘤细胞,却在长期对抗中逐渐丧失战斗力。这种现象在恶性程度高的弥漫大B细胞淋巴瘤(DLBCL)中尤为突出,约40%患者对标准R-CHOP方案治疗无响应。更令人困惑的是,这些"疲惫的免疫战士"为何会"罢工"?近年研究发现,细胞代谢异常可能是关键推手,但具体机制仍是未解之谜。
为揭开这一谜团,川北医学院附属医院的研究团队开展了一项创新性研究。他们采用单细胞RNA测序(scRNA-seq)这一"细胞显微镜"技术,对7例DLBCL患者和4例对照样本的6278个CD8+T细胞进行了高精度解析,结合120例临床样本验证,绘制出迄今最完整的DLBCL免疫代谢图谱。
研究首先通过多组学技术锁定了关键靶点:
单细胞RNA测序分析发现CD8+TILs存在7个功能亚群,其中CD8-4亚群同时具有最高耗竭评分和最显著代谢异常
通过ScMetabolism算法量化代谢活性,发现氧化磷酸化(OXPHOS)通路在耗竭T细胞中异常活跃
线粒体复合体III关键组分UQCRFS1被鉴定为最佳生物标志物
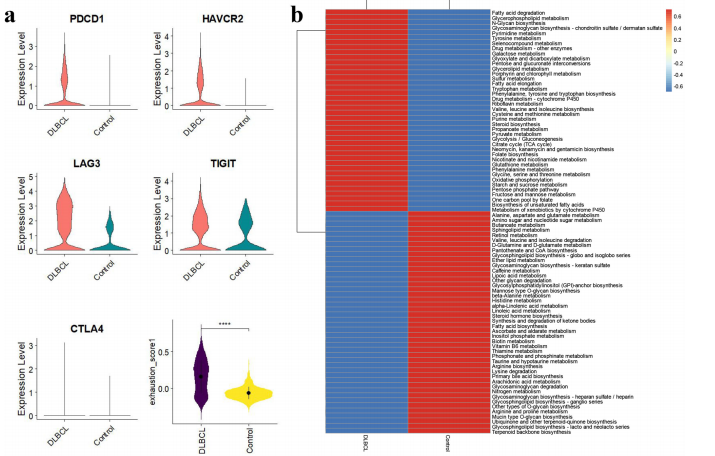
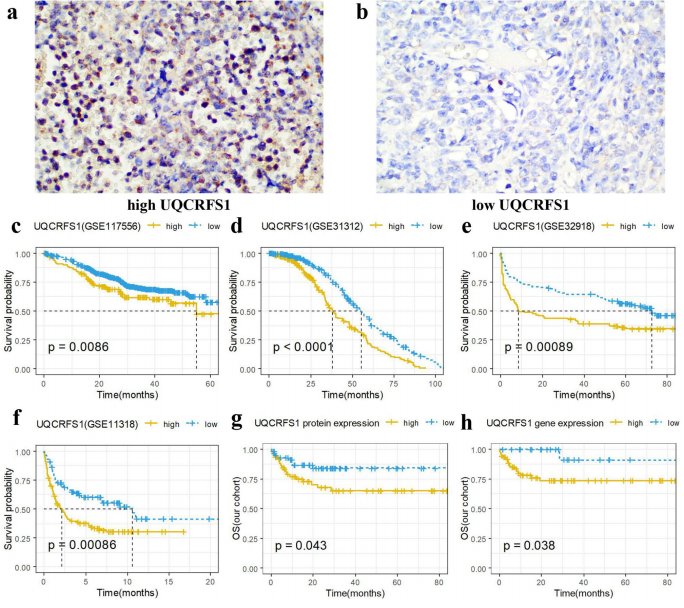
临床意义验证展现出惊人发现:
• 高UQCRFS1组患者5年生存率显著降低(38.2% vs 72.6%)
• 与ABC亚型、晚期分期、高IPI评分等不良特征显著相关
• 预示免疫治疗抵抗:高表达组TIDE评分升高2.3倍
• 重塑肿瘤微环境:M2型巨噬细胞增加3.1倍
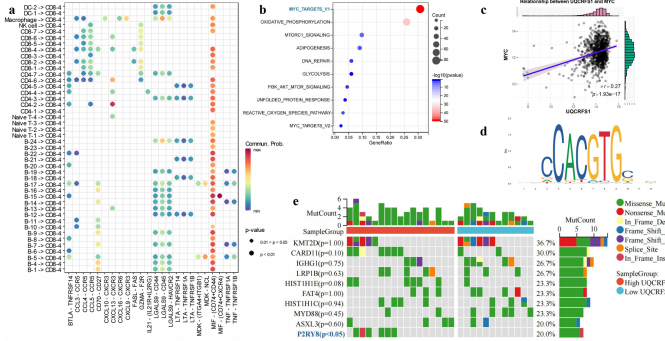
机制探索揭示双重调控网络:
MYC信号轴:通过JASPAR数据库预测并验证MYC可直接结合UQCRFS1启动子
基因突变谱:P2RY8突变频率在高表达组增加4.7倍
这项研究首次系统阐明了OXPHOS代谢通路在DLBCL免疫耗竭中的核心作用,创新性地提出"代谢-表观遗传-免疫"三重调控网络。临床转化方面,UQCRFS1检测可同时实现三重价值:预后预测(风险分层)、治疗方案选择(免疫治疗敏感性评估)和潜在治疗靶点(OXPHOS抑制剂联合治疗)。特别值得注意的是,研究发现MYC/BCL2双打击淋巴瘤中UQCRFS1表达显著升高,这为这类难治性亚群提供了新的治疗思路。
研究采用的scRNA-seq、代谢通量分析、免疫组化等技术构建了从单细胞到组织水平的完整证据链。127例临床样本队列和5个独立数据集验证保证了结论的可靠性。未来研究可进一步探索:①OXPHOS抑制剂是否可逆转T细胞耗竭 ②MYC-P2RY8-UQCRFS1轴的具体调控机制 ③代谢干预与现有免疫治疗的协同效应。这些发现不仅适用于DLBCL,对其它"冷肿瘤"的免疫治疗也有重要借鉴意义。
 生物通微信公众号
生物通微信公众号
知名企业招聘