
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:胶原蛋白疾病的基因编辑治疗进展
【字体: 大 中 小 】 时间:2025年08月13日 来源:Gene Therapy 4.5
编辑推荐:
这篇综述系统阐述了CRISPR-Cas9(簇状规则间隔短回文重复序列)、碱基编辑(BE)和先导编辑(PE)等基因编辑技术在胶原蛋白相关疾病治疗中的应用进展。文章重点分析了针对I型(COL1A1/A2)、IV型(COL4A3-5)、VI型(COL6A1-3)和VII型(COL7A1)胶原蛋白基因突变导致的成骨不全症、Alport综合征和营养不良性大疱性表皮松解症等疾病的基因治疗策略,同时探讨了新型mRNA转接(REVeRT/StitchR)和位点特异性整合(PASTE)技术的转化潜力。
作为脊椎动物和无脊椎动物中最丰富的蛋白质,胶原蛋白在维持组织结构完整性和生理过程中发挥关键作用。最新研究颠覆了传统认知——小鼠模型中胶原蛋白仅占雌性总蛋白的12%和雄性的17%,且组织分布差异显著:脑和肝脏仅含0.1%,而肌腱高达40-50%。人类基因组编码28种胶原蛋白(I-XXVIII型),由至少45个基因组成,其标志性的Gly-Xaa-Yaa三肽重复序列通过脯氨酸和赖氨酸残基的羟基化、糖基化等翻译后修饰稳定三螺旋结构。
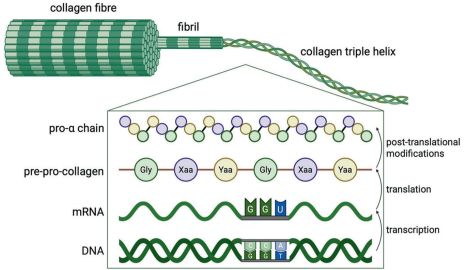
胶原蛋白突变可导致多系统病变,从局部组织异常到严重全身并发症。超过1000种已知致病突变影响17种胶原蛋白,临床表现包括皮肤病变、关节疼痛、心血管异常等。值得注意的是,影响三螺旋结构甘氨酸残基的错义或无义突变通常导致更严重的显性负效应,这与胶原蛋白网络组装受损密切相关。
CRISPR-Cas系统已成为最通用的基因编辑工具,其通过sgRNA引导Cas9核酸酶产生DNA双链断裂(DSB),随后通过同源定向修复(HDR)实现精确编辑。为规避DSB风险,碱基编辑(BE)和先导编辑(PE)技术应运而生——BE将脱氨酶与Cas9切口酶融合实现单碱基转换,而PE利用工程化逆转录酶写入新遗传信息。
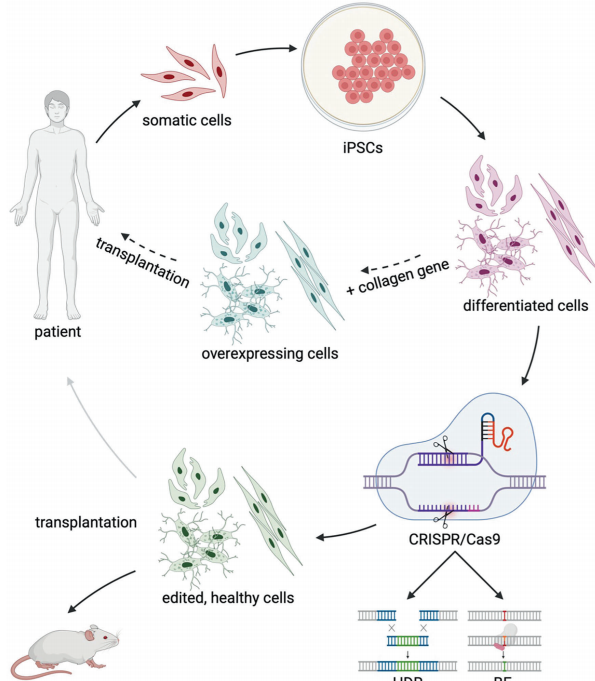
I型胶原疾病:针对成骨不全症,CRISPR-Cas9介导的COL1A1校正使患者来源iPSC分化的成骨细胞胶原表达恢复,星形聚合物(STAR)递送系统实现84%的编辑效率。更令人振奋的是,重组AAV载体在OI小鼠模型中成功改善骨架构,减少自发性骨折。
IV型胶原疾病:Alport综合征治疗中,双质粒CRISPR系统对COL4A3 p.(Gly856Glu)和COL4A5 p.(Gly624Asp)突变实现44-59%校正效率,且indel形成率低于10.4%。这种策略为单基因肾病治疗提供了范式。
VII型胶原疾病:营养不良性大疱性表皮松解症(DEB)的治疗突破最为显著——碱基编辑器ABE8e对COL7A1 c.5047C>T突变实现94.6%校正,纳米针技术更达到100%效率。临床级慢病毒载体移植治疗显示7年后70%创面愈合改善,成为首个FDA批准的胶原疾病基因疗法。
mRNA转接技术(REVeRT/StitchR)通过核酶介导的片段连接突破AAV载体4.7kb包装限制,而位点特异性整合系统(PASTE)则实现无DSB的大片段DNA精准插入。不过,体内递送效率(特别是神经元和视网膜细胞)、脱靶效应控制仍是主要挑战。新型非病毒载体如分支聚β-氨基酯(HPAEs)和核糖核蛋白复合物(RNP)展现出良好前景。
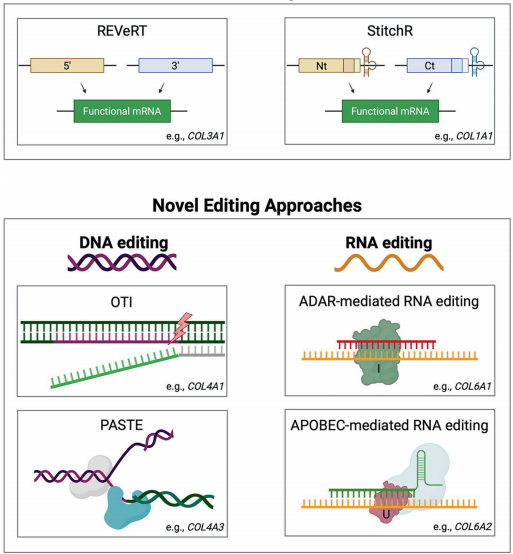
随着ADAR介导的RNA编辑和APOBEC-Cas13融合系统发展,未来可能实现更安全的瞬时基因调控。这些技术进步正推动胶原疾病治疗从症状管理向根本性治愈转变,为300多种遗传性胶原病变患者带来新希望。
 生物通微信公众号
生物通微信公众号
知名企业招聘