
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:DNA损伤、基因组不稳定性和胞质DNA感知之间的反馈环路促进COVID-19细胞因子产生
【字体: 大 中 小 】 时间:2025年08月12日 来源:Archives of Virology 2.5
编辑推荐:
这篇综述深入探讨了SARS-CoV-2感染中DNA损伤(通过ORF6/NSP13蛋白降解CHK1)、胞质DNA(cfDNA/cfChPs/mtDNA)感知通路(cGAS-STING/AIM2/NLRP3)与细胞因子风暴(IL-1β/IL-18/IL-6)的恶性循环,为COVID-19重症患者的免疫病理机制提供了新见解,并指出靶向DNA感知通路可能成为治疗策略。
DNA损伤诱导的恶性循环
SARS-CoV-2通过ORF6和NSP13蛋白降解检查点激酶1(CHK1),导致ATR通路受损,引发γH2AX焦点和微核(MN)形成。这些MN的脆弱核膜易破裂,释放DNA片段至胞质,激活cGAS-STING通路。同时,垂死细胞释放的游离染色质颗粒(cfChPs)通过内吞作用进入邻近细胞,线粒体DNA(mtDNA)因氧化应激泄漏,共同构成"自我DNA风暴"。
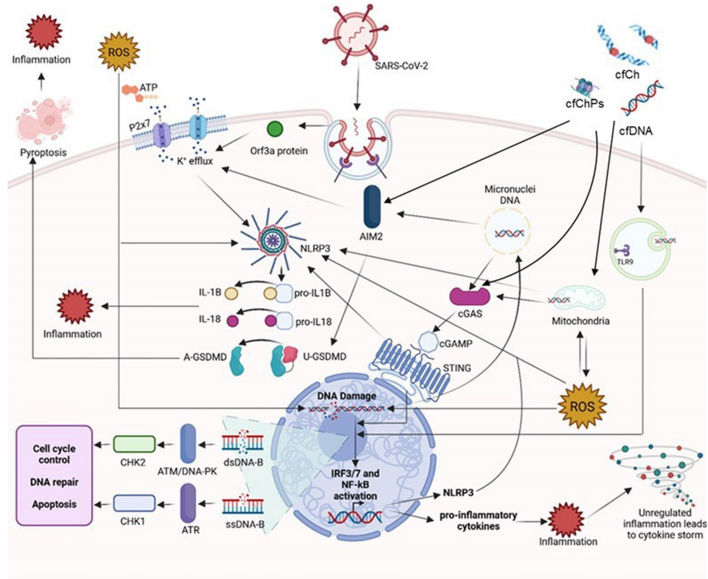
三大DNA感知通路的核心作用
cGAS-STING轴通过合成2'3'-cGAMP激活IRF3/NF-κB,驱动I型干扰素和IL-6产生。AIM2直接结合dsDNA组装炎症小体,切割GSDMD引发焦亡并释放IL-1β/IL-18。NLRP3虽不直接识别DNA,但通过mtDNA/ROS/K+外流间接激活,与SARS-CoV-2病毒孔蛋白3a协同放大炎症。单细胞测序显示,重症患者外周血单核细胞中AIM2/NLRP3表达显著升高,与肺纤维化进展正相关。
独特的细胞因子特征
与其他呼吸道病毒不同,COVID-19患者呈现IL-18特异性高表达,其水平与疾病严重程度呈正相关。尽管IL-6曾被寄予厚望,但临床试验显示其拮抗剂效果有限,而IL-1β/IL-18更可能成为关键靶点。器官移植受者研究显示,供体来源cfDNA与IL-18水平强烈相关,提示DNA感知-细胞因子轴在CRS中的核心地位。
治疗策略与未解之谜
抑制STING可降低p65/RELA二聚体核转位,减轻NF-κB活化。动物模型证实AIM2缺失能减少肺泡巨噬细胞焦亡。有趣的是,轻症患者反而表现出更高水平的细胞损伤标记(核碎裂/核溶解)和特定抗体,这种"轻症悖论"暗示DNA损伤可能具有双重作用——适度激活有利免疫清除,过度反应则导致病理损伤。
未来展望
cfDNA/cfChPs作为生物标志物的潜力值得探索,其与代谢疾病(糖尿病/肥胖)的已知关联可能解释COVID-19合并症机制。靶向DNA修复通路(如ATR抑制剂)或可打破"DNA损伤-炎症-更多DNA泄漏"的恶性循环,但需精准把握干预时机以避免免疫抑制风险。
 生物通微信公众号
生物通微信公众号
知名企业招聘