
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:沉默的守护者:T细胞静息状态中的转录网络
【字体: 大 中 小 】 时间:2025年08月06日 来源:Experimental & Molecular Medicine 9.5
编辑推荐:
这篇综述深入探讨了T细胞静息(quiescence)的分子调控机制,重点阐述了转录因子(如KLF2、FOXO1、FOXP1、BACH2)和转录后调控因子(如BTG1/2)如何通过调控细胞周期、代谢重编程和效应分化等关键通路维持免疫稳态。文章系统梳理了静息T细胞特有的"可逆性生长停滞"特征,及其在自身免疫病、肿瘤免疫和免疫缺陷等疾病中的病理意义,为理解T细胞生物学提供了新视角。
在成年哺乳动物体内,大多数T细胞处于静息状态——这种可逆的生长停滞状态是维持免疫稳态的关键。静息T细胞具有独特的生物学特征:停滞在G0期、细胞体积较小、代谢活性低下,同时保持对激活信号的高度敏感性。这种"静而不止"的状态需要精密调控,其失调与自身免疫、免疫缺陷和肿瘤免疫密切相关。
T细胞的静息程序始于胸腺发育阶段,在CD4+CD8+双阳性向单阳性过渡时启动,成熟后通过淋巴循环系统维持静息状态。这些细胞持续接受微环境信号,包括IL-7细胞因子、持续性TCR(T cell receptor)刺激和鞘氨醇-1-磷酸(S1P)等,共同构成静息维持的外在调控网络。
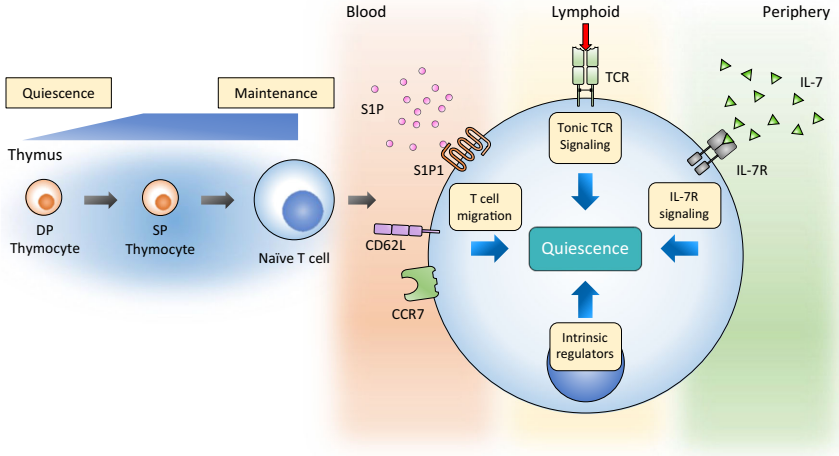
静息T细胞主要依赖氧化磷酸化和脂肪酸β氧化(FAO)维持能量供应,这与激活后转向糖酵解和谷氨酰胺分解的代谢特征形成鲜明对比。PI3K-Akt-mTORC1信号轴是代谢转换的关键开关:PTEN和TSC1/2作为负调控因子防止异常激活,而FOXO1通过抑制Myc和核糖体生物合成来拮抗mTORC1活性。这种代谢"刹车"机制确保T细胞不会过度活化。
KLF2被首次发现通过调控归巢分子(CD62L、CCR7、S1P1)维持T细胞在次级淋巴器官的定位,其缺失会导致T细胞异常迁移和自身免疫倾向。FOXO1则整合多种静息信号:上调IL-7Rα增强生存信号,促进KLF2表达调控迁移,并通过抑制AP-1转录因子家族限制效应基因表达。有趣的是,FOXP1与FOXO1在IL-7R调控上形成"阴阳平衡"——FOXP1通过占据IL-7R增强子区域拮抗FOXO1,防止持续性IL-7信号导致的过度增殖。
BACH2作为"效应分化守门员",通过占据AP-1结合位点和抑制Prdm1(编码BLIMP-1)等关键基因,阻止静息T细胞过早分化为效应细胞。其在超级增强子区域的广泛结合(覆盖26%的CD4+T细胞超级增强子)凸显了其在维持T细胞身份中的核心地位。
BTG1/2的发现为静息维持提供了全新视角:这些蛋白通过PABPC1-CNOT7复合物促进mRNA去腺苷酸化,全局性降低转录本稳定性。这种"分子缓冲"机制提高了T细胞激活阈值,同时储备翻译机器以备快速响应。在淋巴瘤中发现的BTG1Q36H突变证实,该通路失调会导致Myc信号异常激活和恶性增殖。
KLF2增强子变异与系统性红斑狼疮风险相关;FOXO1缺陷导致自发结肠炎;BACH2突变与哮喘、克罗恩病等多种自身免疫病相关。而在肿瘤免疫领域,操纵静息相关因子(如过表达FOXO1)可增强CAR-T细胞的记忆特征和持久性,这为肿瘤免疫治疗提供了新策略。
静息T细胞的"最小化生存"策略蕴含着精妙的调控智慧。深入理解这些机制不仅有助于解析自身免疫和免疫缺陷的发病机理,更为肿瘤免疫治疗提供了新的干预靶点。未来研究需要进一步揭示不同T细胞亚群静息特征的异质性,以及微环境信号与内在调控网络的动态互作机制。
 生物通微信公众号
生物通微信公众号
知名企业招聘