
-

生物通官微
陪你抓住生命科技
跳动的脉搏
肠道共生菌Phascolarctobacterium succinatutens通过MYC驱动的精氨酸生物合成表观遗传调控减少脂肪积累
【字体: 大 中 小 】 时间:2025年08月04日 来源:npj Biofilms and Microbiomes 9.2
编辑推荐:
本研究针对畜牧业中过度脂肪沉积问题,通过129头商品约克夏猪的菌群全关联分析,发现低背膘厚(LBF)猪肠道内Phascolarctobacterium succinatutens丰度显著升高并与血清精氨酸水平正相关。粪菌移植(FMT)和单菌定植实验证实该菌通过代谢产物丙酸盐抑制TLR4信号通路减轻肠道炎症,并通过降低MYC染色质可及性促进精氨酸合成,最终经PI3K/Akt/FOXO3a通路减少脂肪沉积。研究为益生菌抗肥胖机制提供了新见解,对商业猪种脂肪调控具有重要应用价值。
在现代畜牧业生产中,过度脂肪沉积不仅影响动物健康,更直接损害集约化养殖的经济效益。猪肉作为全球主要蛋白质来源,其瘦肉率与脂肪沉积的平衡一直是育种工作的重点。然而,尽管已知肠道微生物群在调节宿主代谢平衡中发挥关键作用,但商业猪种中能够有效减少过度脂肪沉积的关键菌种及其作用机制仍不明确。湖南农业大学的研究团队在《npj Biofilms and Microbiomes》发表的研究,揭示了肠道共生菌Phascolarctobacterium succinatutens通过表观遗传调控精氨酸生物合成的新机制。
研究团队首先对129头商品约克夏猪进行菌群全关联分析,结合16S rRNA测序、宏基因组测序和非靶向代谢组学技术,通过粪菌移植实验、单菌定植小鼠模型,并整合转录组学和染色质可及性测序(ATAC-seq)等多组学方法。研究发现低背膘厚猪群肠道中P. succinatutens丰度显著升高,且与血清精氨酸水平呈正相关。
通过16S rRNA测序将猪群分为四个微生物群落簇,其中C2簇表现出较低的背膘厚度和较高的眼肌面积。菌群全关联分析显示P. succinatutens是与背膘厚度负相关最强的菌种。宏基因组分析进一步证实该菌在低背膘厚猪群中作为关键"驱动"菌存在。
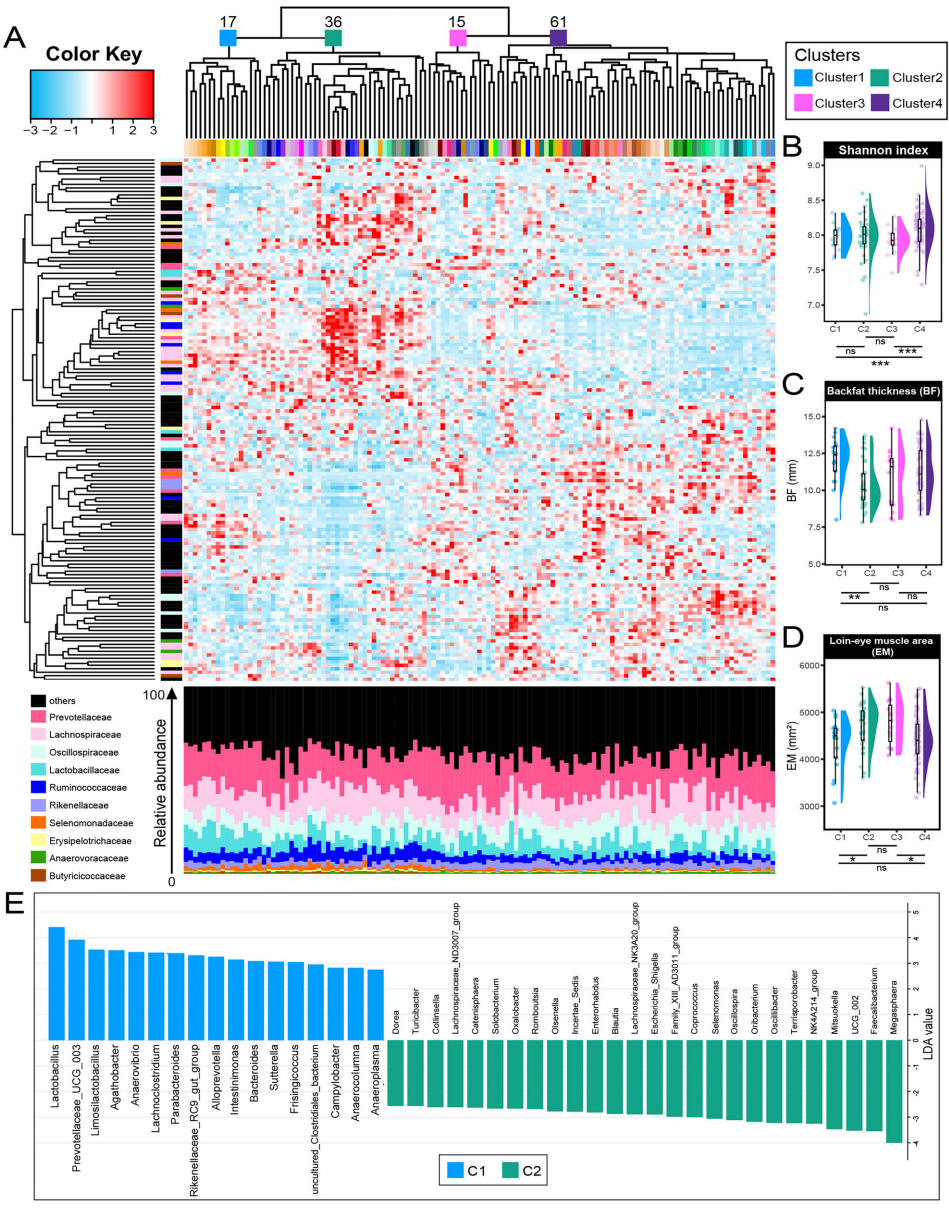
宏基因组功能注释显示低背膘厚猪群中精氨酸生物合成过程显著激活。代谢组学发现296种差异代谢物,其中精氨酸、胆酸和甘胆酸水平与P. succinatutens丰度正相关。值得注意的是,低背膘厚猪群粪便丙酸盐水平显著升高,而血清促炎因子TNF-α和IL-6水平降低。
将低背膘厚猪粪菌移植至高脂饮食小鼠,显著改善了肥胖症状,增加血清精氨酸和粪便丙酸盐水平,同时降低血清总胆固醇(TChol)、甘油三酯(TG)和葡萄糖水平。结肠转录组分析显示精氨酸合成相关基因(Gls2、Ass1和Asl)表达上调。
单菌定植实验证实P. succinatutens可减轻高脂饮食诱导的肥胖,减小脂肪细胞体积,降低脂肪酸转运基因(Fabp2、Fabp4)表达。该菌产生的丙酸盐是其关键活性成分,培养实验显示其能产生大量丙酸盐、乙酸和异戊酸。
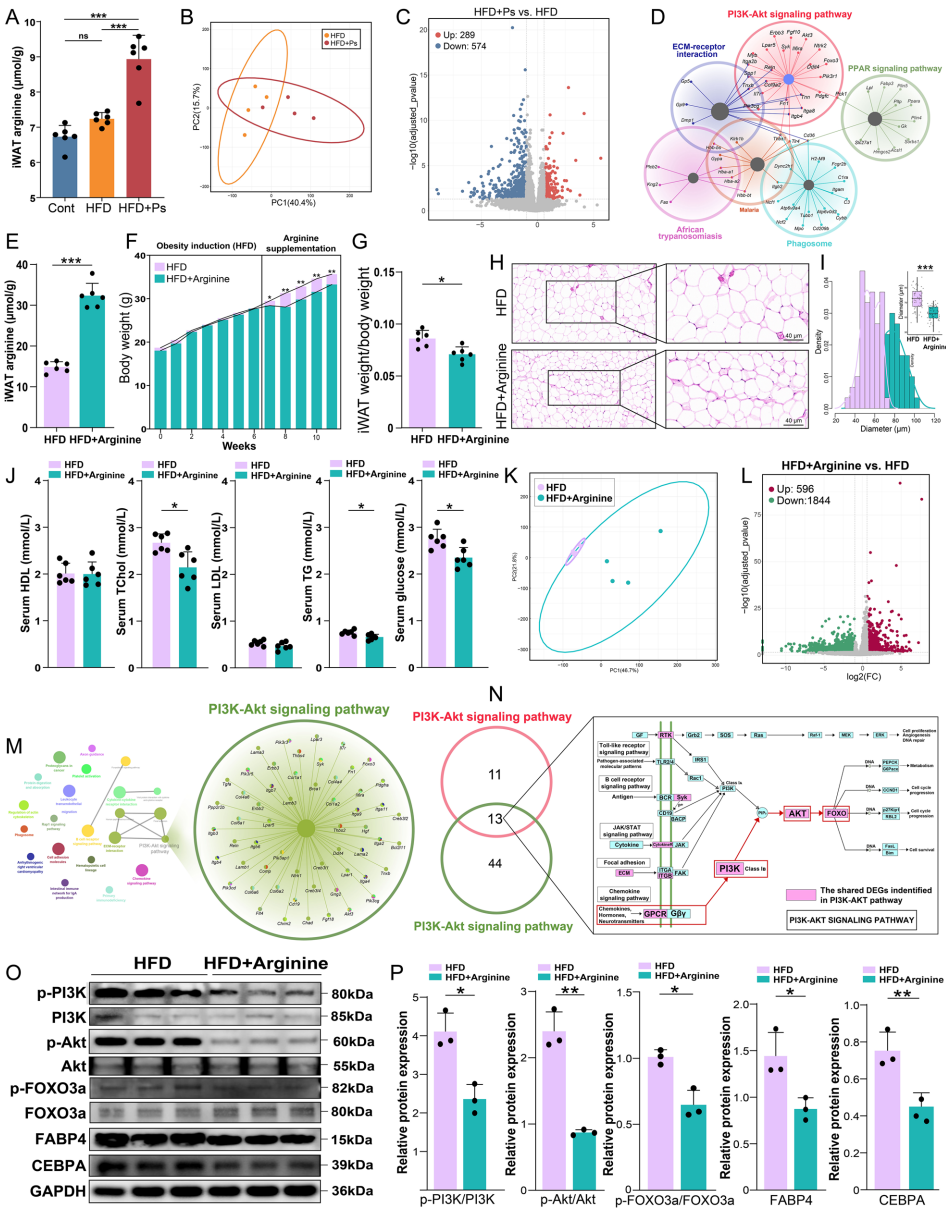
体外结肠组织培养实验表明,丙酸盐处理降低培养上清中IL-6、IL-1β和TNF-α水平,同时增加精氨酸含量。RNA-seq和ATAC-seq分析发现丙酸盐降低MYC基因座染色质可及性,从而下调MYC表达,解除其对谷氨酰胺转运体(SLC1A5和SLC38A5)的抑制,促进精氨酸合成。
精氨酸干预实验显示,补充精氨酸可增加脂肪组织中精氨酸含量,抑制PI3K/Akt/FOXO3a信号通路活性,降低脂肪生成相关蛋白(FABP4和CEBPA)表达,最终减少脂肪沉积。
该研究首次揭示了P. succinatutens通过"菌群-代谢物-表观遗传"轴调控脂肪沉积的新机制:其产生的丙酸盐一方面通过抑制TLR4/MyD88/NF-κB信号减轻肠道炎症;另一方面通过降低MYC染色质可及性,促进精氨酸合成,最终经PI3K/Akt/FOXO3a通路减少脂肪积累。这一发现不仅为商业猪种的脂肪沉积调控提供了新策略,也为人类肥胖的微生物干预提供了理论依据。研究创新性地将微生物组学、代谢组学与表观遗传调控相结合,为理解菌群-宿主互作提供了多维视角。
 生物通微信公众号
生物通微信公众号
知名企业招聘