
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:家畜卵泡发育和闭锁中程序性细胞死亡的机制
【字体: 大 中 小 】 时间:2025年08月04日 来源:Journal of Animal Science and Biotechnology 6.5
编辑推荐:
这篇综述深入探讨了程序性细胞死亡(PCD)在家畜卵泡发育和闭锁中的核心作用,聚焦自噬(autophagy)、凋亡(apoptosis)和铁死亡(ferroptosis)三种PCD形式的分子机制及其互作网络。通过解析激素(如FSH/LH)调控、关键基因(如ATG7/Bcl-2/GPX4)表达及氧化应激(ROS)等通路,为改善家畜繁殖效率提供了新靶点。
卵泡发育始于原始卵泡,通过抗苗勒氏管激素(AMH)维持静息状态。促卵泡激素(FSH)激活PI3K/AKT/mTOR通路促进颗粒细胞(GCs)增殖,而卵母细胞分泌的生长分化因子9(GDF-9)通过SMAD2/3增强卵泡-颗粒细胞通讯。随着卵泡进入窦腔阶段,黄体生成素(LH)刺激卵泡膜细胞合成雄激素,GCs将其转化为雌激素,优势卵泡通过负反馈抑制FSH导致次级卵泡闭锁。
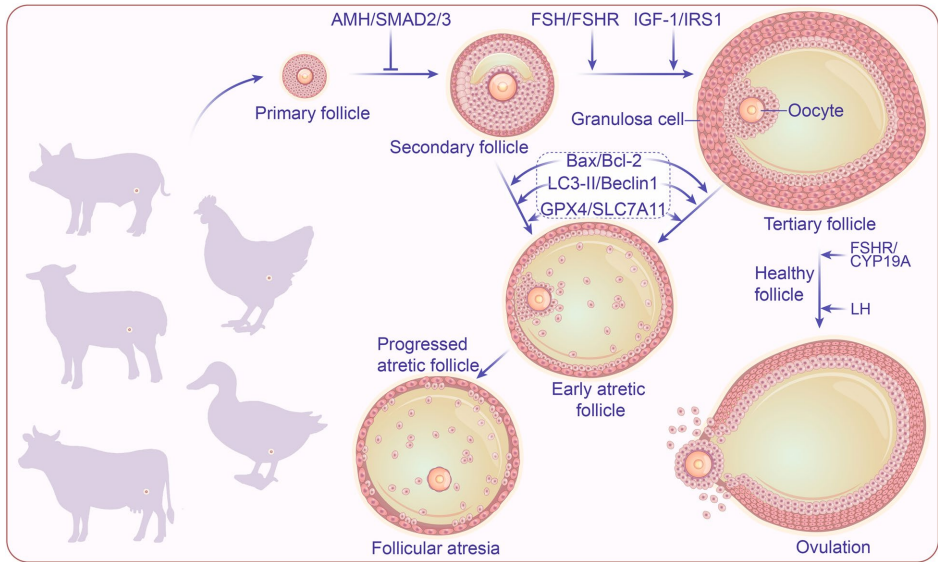
自噬的双面性:适度自噬通过清除受损线粒体维持GCs存活,但过度激活会释放溶酶体酶激活caspase级联反应,加速闭锁。鹅模型显示,ROS通过mTOR通路诱导自噬相关基因(如LC3-II/ATG5)上调,而miR-30a-5p通过靶向Beclin1抑制自噬。
凋亡的主导作用:颗粒细胞凋亡是闭锁的标志事件,Bcl-2家族(如Bax/Bcl-2)调控线粒体膜通透性,释放细胞色素c(Cyt c)激活caspase-3。猪卵巢中,FSH通过HIF-1α/PINK1/Parkin通路抑制缺氧诱导的凋亡,而p53通过转录激活促凋亡因子PUMA推动闭锁。
铁死亡的氧化风暴:铁过载通过Fenton反应产生活性氧(ROS),导致脂质过氧化和GPX4活性抑制。PCOS患者GCs中,铁死亡相关基因(如SLC7A11/NRF2)失调与卵泡发育障碍相关。

自噬可通过清除受损线粒体抑制凋亡,但溶酶体破裂会激活caspase;铁死亡与凋亡共享ROS调控节点,如Bcl-2家族调控线粒体ROS释放。靶向干预策略(如CRISPR敲除Bax或维生素E抗氧化)在提高牛/猪排卵率中展现潜力。
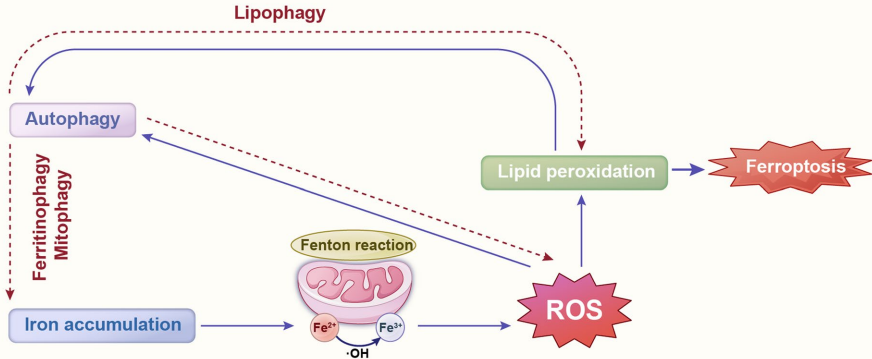
单细胞测序可揭示PCD时空动态,而靶向GPX4或FSHR的分子育种有望提升繁殖性能。PCOS和卵巢早衰(POF)等疾病中PCD通路的失调为治疗提供了新视角。
 生物通微信公众号
生物通微信公众号
知名企业招聘