
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Ptpn11突变相关JMML中白血病起始干细胞劫持先天免疫机制获得选择性优势及免疫逃逸
【字体: 大 中 小 】 时间:2025年08月02日 来源:Cell Reports 6.9
编辑推荐:
本研究针对Ptpn11突变相关青少年粒单核细胞白血病(JMML)的发病机制,揭示了白血病起始干细胞通过异常激活髓系转录程序,高表达先天免疫相关蛋白S100a9/S100a8,获得选择性生长优势并招募髓系来源抑制性细胞(MDSCs)实现免疫逃逸的关键机制。研究人员通过单细胞转录组分析、发育轨迹重建和功能验证,发现抑制S100a9/S100a8信号可有效阻断白血病发展,为靶向白血病干细胞提供了新策略。
青少年粒单核细胞白血病(JMML)是一种致命的儿童血液肿瘤,其中PTPN11基因突变患者预后最差。尽管已知突变发生在造血干细胞(HSC),但突变干细胞如何获得竞争优势并逃避免疫监视仍是未解之谜。安徽医科大学病理生理学系与埃默里大学医学院的研究团队在《Cell Reports》发表突破性研究,首次揭示Ptpn11E76K/+突变干细胞通过"劫持"先天免疫机制实现恶性转化的全过程。
研究人员采用诱导型Ptpn11E76K/+小鼠模型,通过流式分选富集干细胞后,结合单细胞转录组测序(scRNA-seq)技术系统分析了突变干细胞至成熟髓系细胞的发育轨迹。运用基因集富集分析(GSEA)、细胞间通讯分析等生物信息学方法,结合体外功能实验和患者样本验证,揭示了S100a9/S100a8的核心作用。
Ptpn11E76K/+突变干细胞异常激活髓系转录程序
单细胞聚类发现突变长期造血干细胞(LT-HSC)中髓系分化相关基因Cebpb、Cebpe表达显著上调,而干细胞特征基因Hoxa5、Hoxa7等下调。最显著的变化是先天免疫相关基因S100a9(29倍)和S100a8(24倍)的异常高表达,这些通常仅在成熟髓系细胞中表达的抗菌肽和促炎蛋白,在突变干细胞中呈现"从头激活"特征。
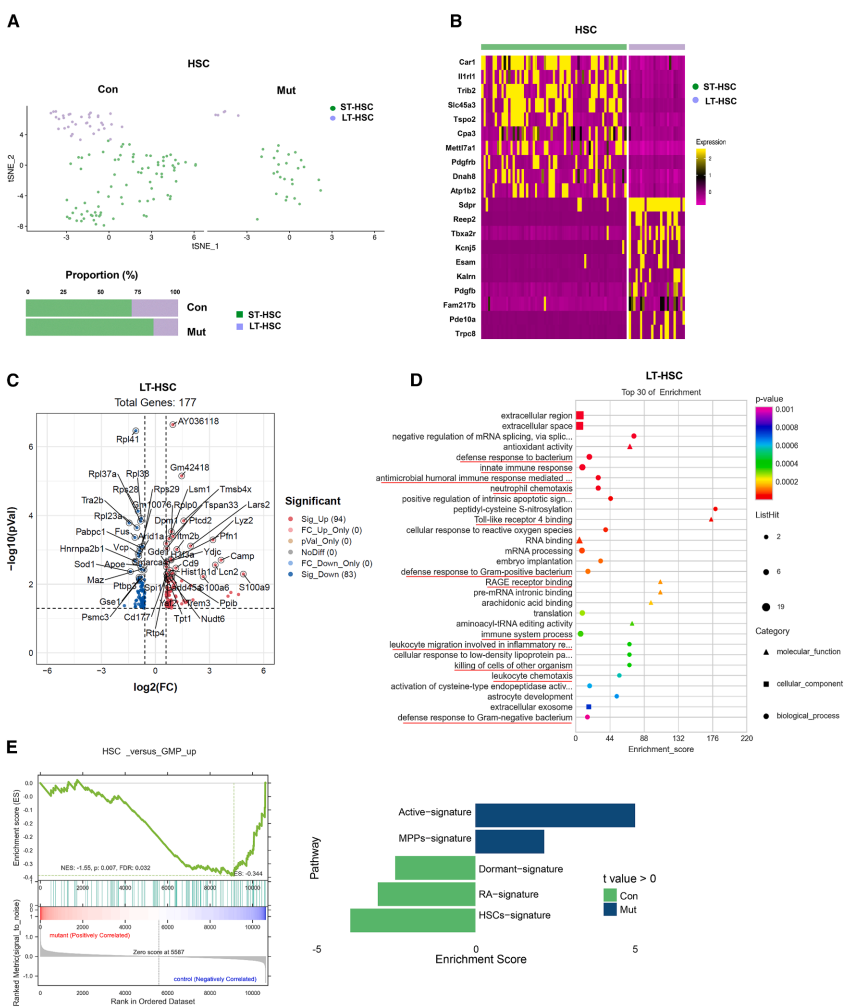
S100a9/S100a8的双重致病机制
功能实验证实S100a9/S100a8通过自分泌作用促进突变干细胞增殖:①体外培养显示突变干细胞集落形成能力增强,但可被S100a9/S100a8抑制剂tasquinimod逆转;②通过受体Rage/TLR4激活下游信号。更重要的是,这些蛋白作为损伤相关分子模式(DAMPs)分子,显著增强CD11b+Ly6G+髓系来源抑制性细胞(MDSCs)的迁移能力,创建免疫抑制微环境。
发育轨迹与细胞互作的重编程
伪时序分析显示突变干细胞呈现加速分化倾向,粒细胞-巨噬细胞祖细胞(GMP)亚群出现特异性发育偏移。细胞通讯网络分析发现,突变干细胞与中性粒细胞间的IL-1β、TGF-β信号交流增强,形成促炎正反馈环。转录因子调控网络分析进一步证实,突变干细胞中髓系转录因子Ets1、Cebpe活性显著升高。
靶向干预的治疗潜力
在疾病模型中,tasquinimod治疗4周可使外周血突变细胞减少50%,脾肿大改善,并显著降低干细胞增殖指数(G2/M期细胞减少)。患者样本验证显示,PTPN11突变JMML患者的CD34+干细胞中S100A8/S100A9表达较正常对照升高7倍。
该研究首次阐明JMML起始干细胞通过异常激活髓系转录程序和先天免疫反应实现恶性转化的机制,突破性地指出S100a9/S100a8-Rage/TLR4轴是连接突变干细胞内在变异与免疫微环境重塑的关键枢纽。这不仅解释了为何Ptpn11突变特别容易导致髓系肿瘤,更为重要的是,证实靶向该通路可同时消除突变干细胞的选择优势并恢复免疫监视,为开发根治性疗法提供了新靶点。研究提出的"突变干细胞劫持免疫机制"理论框架,也可能适用于其他血液肿瘤的发病机制研究。
 生物通微信公众号
生物通微信公众号
知名企业招聘