
-

生物通官微
陪你抓住生命科技
跳动的脉搏
circUBE2G1编码的新型蛋白circUBE2G1-99aa通过结合ENO1抑制胃癌糖酵解的机制研究
【字体: 大 中 小 】 时间:2025年07月31日 来源:Cell Death Discovery 7
编辑推荐:
本研究针对胃癌(GC)代谢重编程的关键问题,首次揭示了circUBE2G1编码的99aa蛋白通过直接结合糖酵解酶ENO1,抑制其活性并阻断PI3K/AKT通路,从而抑制胃癌细胞增殖和转移的分子机制。该发现为胃癌诊断提供了新型生物标志物,并为靶向肿瘤代谢的治疗策略开辟了新途径。
胃癌作为全球第五大高发恶性肿瘤,其高死亡率与肿瘤微环境重塑和代谢异常密切相关。其中,Warburg效应(即有氧糖酵解增强)是胃癌细胞能量代谢的典型特征,但调控这一过程的非编码RNA机制尚不明确。与此同时,环状RNA(circRNA)作为新型调控分子,其编码小蛋白的功能在肿瘤中仍属研究前沿。
南京医科大学附属苏州医院的研究团队在《Cell Death Discovery》发表重要成果,通过整合GEO数据库、RNC-seq(核糖体结合RNA测序)和TransCirc数据库分析,首次鉴定出在胃癌中显著下调的circUBE2G1能编码具有肿瘤抑制功能的99氨基酸(circUBE2G1-99aa)蛋白。该蛋白通过结合糖酵解关键酶ENO1(烯醇化酶1)的TIM barrel催化结构域,抑制其酶活性和下游PI3K/AKT信号通路,最终阻断胃癌细胞的糖酵解进程和恶性表型。
研究采用多组学分析结合实验验证的策略,关键技术包括:1)从60对临床样本中筛选差异表达circRNA;2)RIP(RNA免疫沉淀)和RNA pull-down验证QKI(RNA结合蛋白)调控circUBE2G1环化;3)质谱鉴定circUBE2G1-99aa与ENO1的相互作用;4)Seahorse能量代谢分析仪检测糖酵解指标ECAR(细胞外酸化率)和OCR(氧消耗率);5)裸鼠移植瘤模型验证体内抑瘤效果。
circUBE2G1的鉴定与临床特征
通过circRNA芯片和RNC-seq联合分析发现,circUBE2G1在胃癌组织中表达显著降低(P<0.001),其低表达与肿瘤大小(P=0.003)、淋巴结转移(P=0.007)和TNM分期(P=0.01)显著相关。核质分离实验显示circUBE2G1主要定位于细胞质,RNase R耐受实验证实其环状结构稳定性。
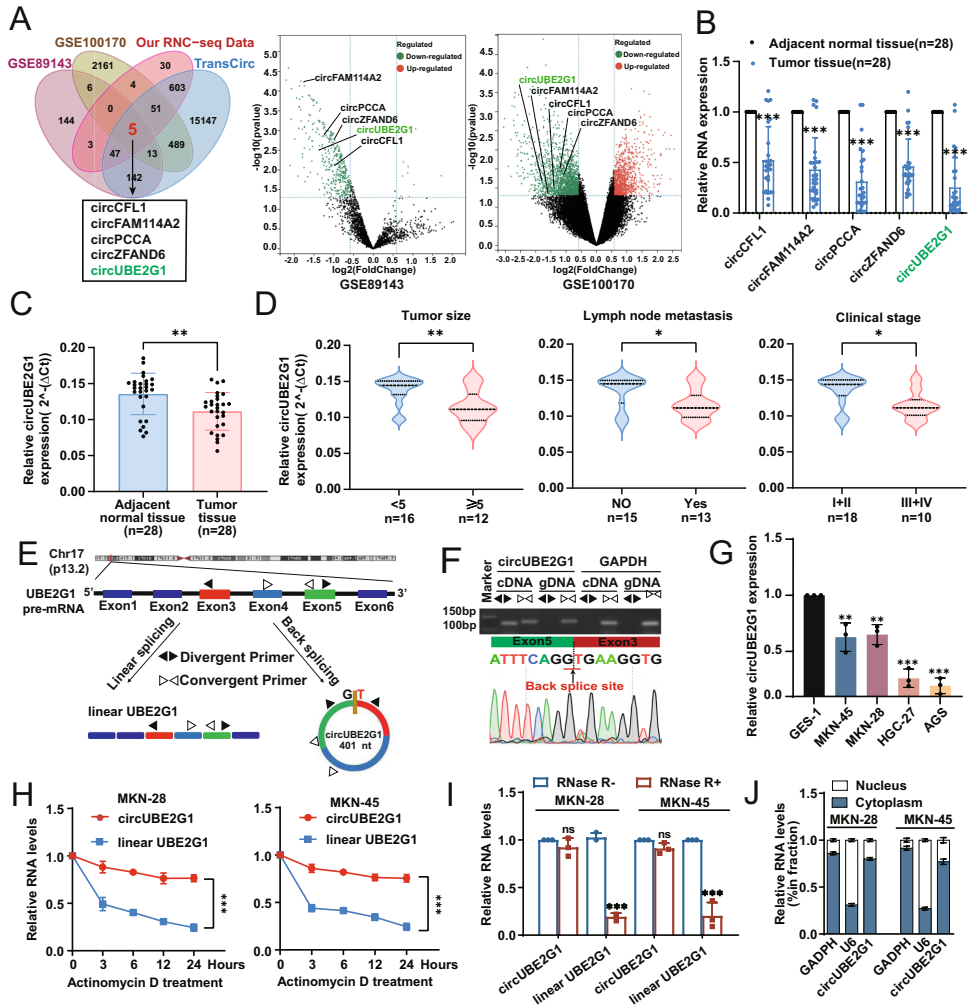
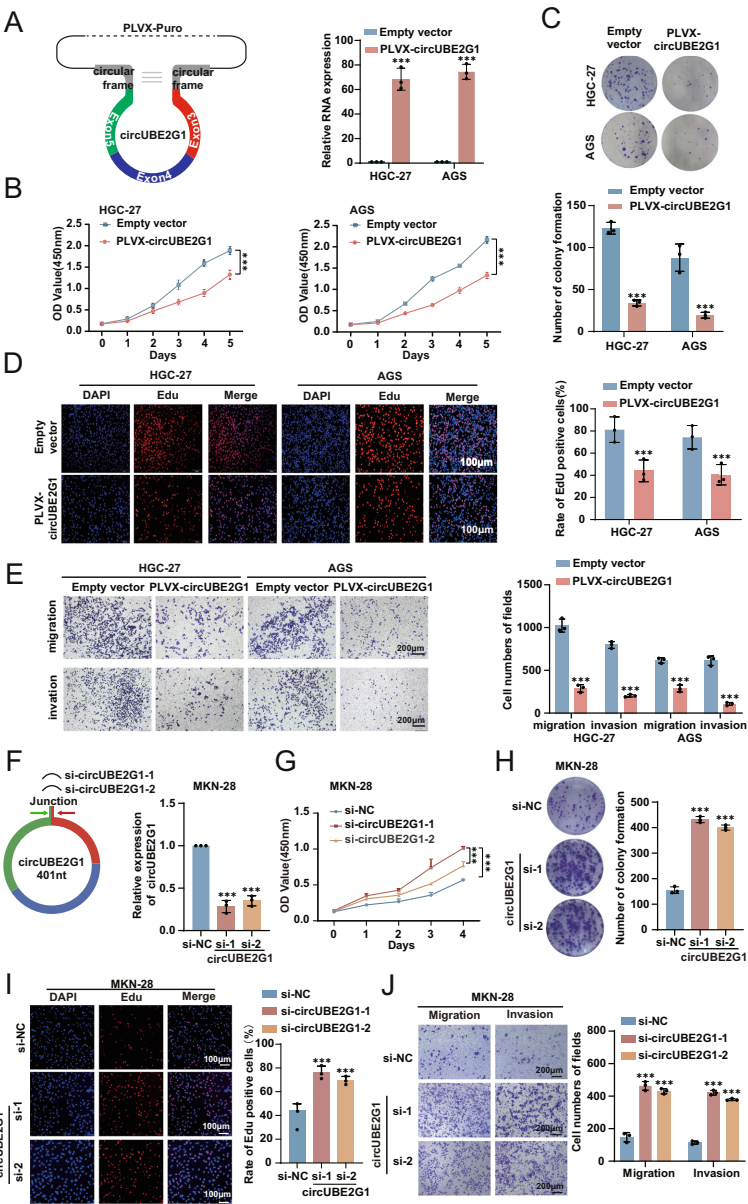
circUBE2G1-99aa的发现与功能
生物信息学预测结合双荧光素酶报告基因实验证实,circUBE2G1含有功能性IRES(内部核糖体进入位点),可翻译产生15 kDa的circUBE2G1-99aa。质谱分析在胃癌组织和细胞中均检测到该蛋白的特异性肽段。功能实验显示,过表达circUBE2G1-99aa(而非ATG突变体)可抑制胃癌细胞增殖(CCK-8检测P<0.001)、迁移(Transwell实验减少60%)和裸鼠成瘤能力(肿瘤体积缩小55%)。
分子机制解析
Co-IP(免疫共沉淀)结合质谱鉴定出93个互作蛋白,KEGG富集分析显示这些蛋白显著富集于糖酵解通路(P=1.2×10-5)。分子对接模拟发现circUBE2G1-99aa通过C端50-99aa区域结合ENO1的140-434aa催化结构域。酶活检测显示,circUBE2G1-99aa可使ENO1活性降低42%(P=0.002),进而抑制乳酸生成(减少38%)和ATP产量(下降45%)。
信号通路调控
Western blot证实circUBE2G1-99aa可降低p-PI3K(Tyr607)和p-AKT(Ser473)磷酸化水平。使用PI3K激动剂740 Y-P(20 μg/mL)处理可逆转circUBE2G1-99aa对糖酵解的抑制作用,恢复ECAR值达1.8倍(P=0.008)。
该研究首次揭示circUBE2G1-99aa作为ENO1的内源性抑制剂,通过"结合-抑制-调控"三重机制阻断胃癌代谢重编程:1)直接结合ENO1的催化口袋;2)抑制其将2-磷酸甘油酸转化为磷酸烯醇式丙酮酸的酶活性;3)下调PI3K/AKT致癌信号。这不仅为胃癌提供了新型预后标志物(circUBE2G1-99aa表达水平与患者5年生存率显著相关),更开创了靶向circRNA编码蛋白-代谢酶相互作用的治疗新策略。研究涉及的QKI-circUBE2G1-ENO1轴,为理解RNA结合蛋白调控circRNA生物合成与肿瘤代谢的交叉网络提供了范式。
 生物通微信公众号
生物通微信公众号
知名企业招聘