
-

生物通官微
陪你抓住生命科技
跳动的脉搏
单细胞多组学解析雌性哺乳动物减数分裂热点动态与表观遗传调控机制
【字体: 大 中 小 】 时间:2025年07月30日 来源:Cell Reports 7.5
编辑推荐:
本研究针对雌性哺乳动物减数分裂重组热点调控机制不清的难题,通过单细胞ATAC-seq(scATAC-seq)和低输入量MNase-seq等技术,首次在单细胞水平揭示了雌性胚胎生殖细胞(EGCs)中重组热点使用频率的高度异质性,发现PRDM9介导的开放染色质与H3K4me3/H3K9me3双价态特征对热点活性的调控作用,为理解减数分裂性别二态性提供了新视角。
在生命繁衍的奥秘中,减数分裂如同精妙的分子舞蹈,通过同源重组实现遗传物质的洗牌。然而这场舞蹈在雌雄个体间存在显著差异:雄性精子发生持续不断,而雌性的减数分裂仅发生在胚胎发育的短暂窗口期。更令人困惑的是,决定重组位点的"热点"(hotspot)在雌性生殖细胞中如何被精确调控,始终是未解之谜。由于胚胎期生殖细胞数量稀少且高度异质,传统群体水平研究难以捕捉单细胞尺度的动态变化,导致雌性减数分裂调控机制长期笼罩在迷雾中。
为拨开这层迷雾,北京大学生命科学学院生物医学前沿创新中心的研究团队联合同济大学生命科学与技术学院,在《Cell Reports》发表了突破性研究。他们创新性地将单细胞染色质可及性测序(scATAC-seq)与低输入量MNase-seq、超低输入天然染色质免疫沉淀测序(ULI-NChIP-seq)相结合,绘制了雌性小鼠胚胎生殖细胞减数分裂过程中重组热点的单细胞图谱,揭示了PRDM9介导的表观遗传调控网络。
研究团队首先建立了关键技术体系:通过Oct4-EGFP转基因小鼠分离E13.5-E16.5胚胎生殖细胞,利用scATAC-seq在单细胞分辨率鉴定活性重组热点;采用低输入量MNase-seq解析核小体定位动态;结合ULI-NChIP-seq绘制H3K4me3/H3K9me3等组蛋白修饰图谱。这些技术克服了传统方法需要百万级细胞的限制,首次实现了稀少样本的多维度解析。
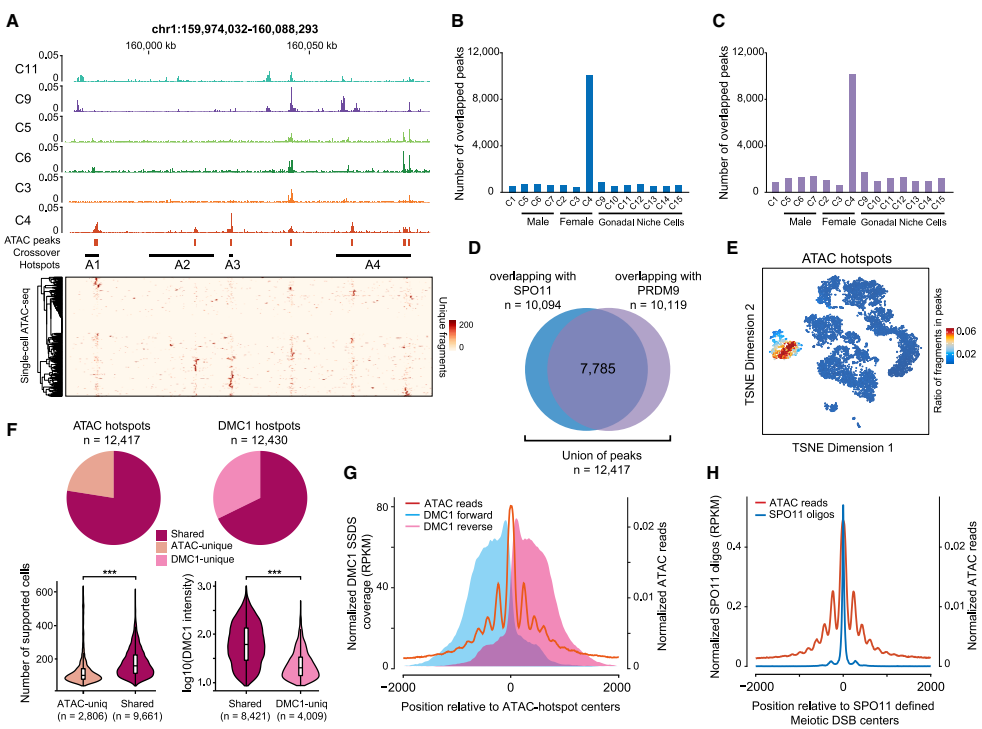
基因组水平鉴定雌性减数分裂热点
通过整合scATAC-seq峰值与已知SPO11-oligo定义的雄性DSB位点,研究鉴定出12,417个雌性特异性重组热点。单细胞分析显示每个生殖细胞平均激活约4,100个热点,但使用频率存在10%-50%的显著异质性。高频热点更早出现且与PRDM9结合强度正相关,这解释了为何PRDM9产生的开放位点远超最终DSB数量。
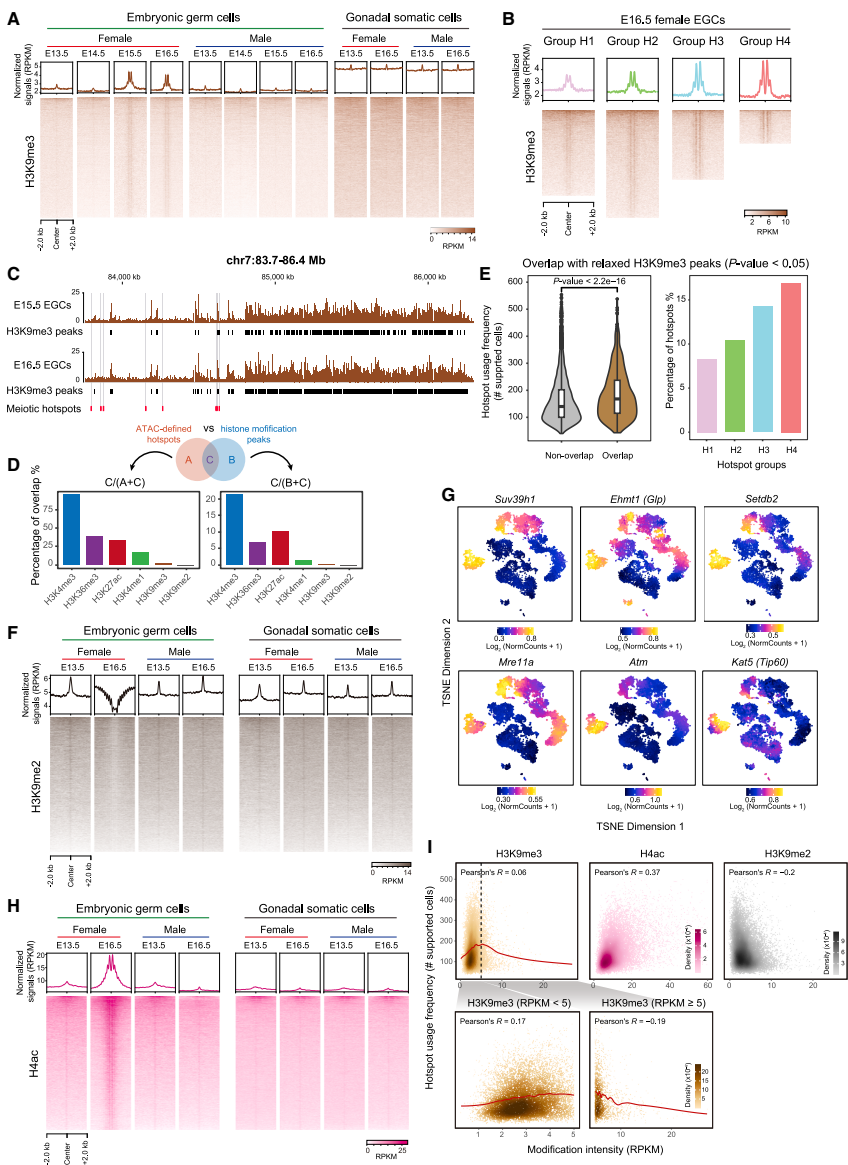
染色质重塑与核小体相位特征
组蛋白修饰的动态图谱
H3K4me3在热点区域呈现典型的三核小体分布模式,而H3K4me1在E14.5出现后被逐步消耗转化为H3K4me3。意外发现热点区域H3K9me3特异性富集,与H3K4me3形成独特的双价态。这种修饰虽不导致异染色质化,但可能通过招募ATM/KAT5(Tip60)复合物参与DSB修复。
H3K9me3的双重调控作用
这项研究建立了雌性减数分裂研究的单细胞多组学范式,不仅阐明PRDM9在雌雄个体中保守的染色质重塑功能,更发现H3K9me3在雌性热点调控中的特殊作用。这些发现为理解减数分裂异常导致的非整倍体疾病提供了分子基础,也为辅助生殖技术中卵子质量评估提供了潜在表观遗传标记。研究揭示的热点选择机制差异,可能解释为何人类PRDM9突变与不孕症存在性别特异性关联,为生殖医学研究开辟了新方向。
 生物通微信公众号
生物通微信公众号
知名企业招聘