
-

生物通官微
陪你抓住生命科技
跳动的脉搏
间充质干细胞外泌体miR-7977通过靶向NFKBIZ抑制Th17分化改善原发性硬化性胆管炎胆管周围纤维化的机制研究
【字体: 大 中 小 】 时间:2025年07月29日 来源:Journal of Nanobiotechnology 10.6
编辑推荐:
本研究针对原发性硬化性胆管炎(PSC)缺乏有效治疗手段的临床难题,通过构建人源多谱系肝脏类器官模型结合Mdr2-/-小鼠模型,首次揭示间充质干细胞外泌体(EVMSC)通过递送miR-7977靶向抑制NFKBIZ/IκBζ表达,阻断Th17细胞分化及IL-17A信号通路,显著改善胆管周围纤维化微环境。该研究为PSC治疗提供了新型靶向策略,发表于《Journal of Nanobiotechnology》。
在肝胆疾病领域,原发性硬化性胆管炎(PSC)被称为"沉默的杀手",这种以胆管进行性纤维化为特征的疾病,最终会导致肝硬化甚至肝功能衰竭。令人担忧的是,目前除肝移植外尚无有效治疗手段,而移植后5年生存率仅约70%。更棘手的是,约80%的PSC患者伴随"洋葱皮样"胆管周围纤维化,这种特殊的病理改变使得药物难以到达病灶部位。近年来,科学家们发现Th17细胞及其分泌的IL-17A在PSC发病中扮演关键角色,但具体机制仍如雾里看花。
浙江大学医学院附属第一医院传染病诊治国家重点实验室的研究人员独辟蹊径,将目光投向具有天然靶向特性的间充质干细胞外泌体(EVMSC)。他们创新性地构建了包含胆管细胞、肝细胞和星状细胞的三维多谱系类器官模型(Mulorgs),结合经典的Mdr2-/-小鼠模型,开展了一系列机制研究。研究发现,EVMSC中富含的miR-7977能够靶向NFKBIZ基因,通过抑制IκBζ蛋白表达,显著降低IL-17A水平,从而打破Th17细胞与胆管周围纤维化的恶性循环。这项突破性成果发表在《Journal of Nanobiotechnology》上,为PSC治疗提供了全新思路。
研究团队运用了多项关键技术:1)从健康供体胎盘分离培养间充质干细胞并提取外泌体;2)利用PSC患者肝移植剩余组织构建包含三种细胞的多谱系类器官;3)通过慢病毒转染构建miR-7977高表达外泌体(EVhigh);4)采用RNA-seq和CUT&Tag技术分析基因调控网络;5)建立FibHO-Th17共培养系统模拟胆管周围微环境。
研究结果部分:
EVMSC定位纤维化区域并改善Mdr2-/-小鼠肝脏病理

EVMSC通过抑制Th17分化减轻肝纤维化

建立模拟PSC胆管周围微环境的多谱系类器官

EV-derived miR-7977靶向NFKBIZ调控Th17分化

EVhigh显著改善胆管周围纤维化微环境
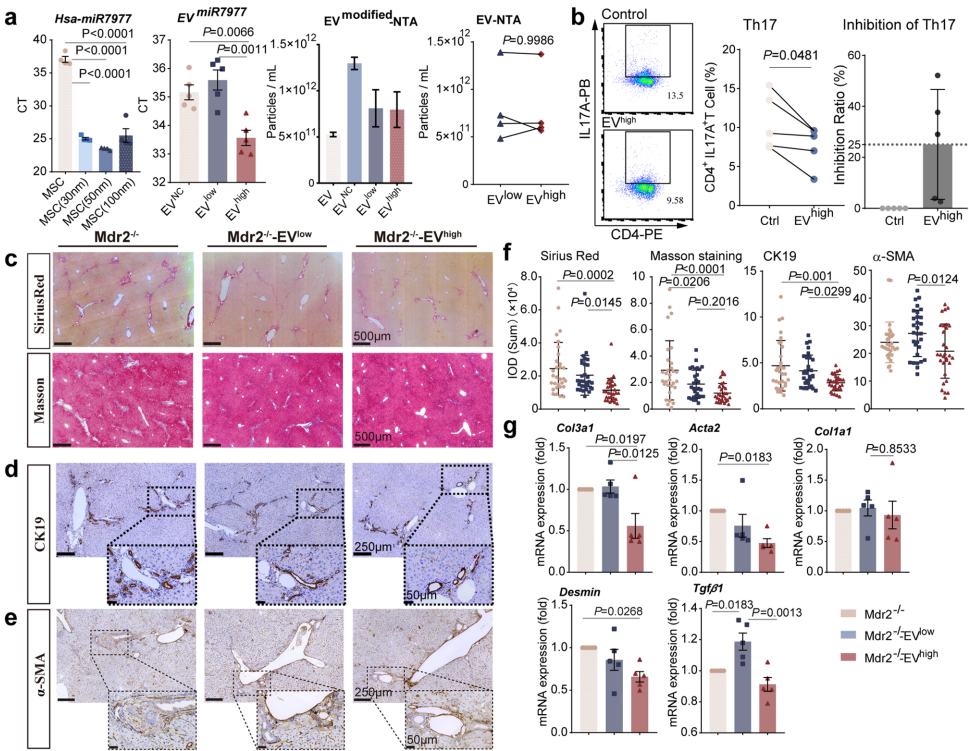
这项研究首次阐明了EVMSC来源的miR-7977通过"NFKBIZ/IκBζ-IL-17A"轴调控Th17分化的分子机制,创新性地建立了模拟人体胆管周围微环境的类器官模型。特别值得注意的是,研究发现PSC患者来源的类器官对miR-7977治疗反应存在个体差异,这为未来开展精准治疗提供了重要依据。从转化医学角度看,该研究不仅为PSC治疗提供了新型候选药物,其构建的多谱系类器官平台还可广泛应用于其他纤维化疾病的机制研究和药物筛选。
 生物通微信公众号
生物通微信公众号
知名企业招聘