
-

生物通官微
陪你抓住生命科技
跳动的脉搏
ID4:破译三阴性乳腺癌侵袭性驱动机制与靶向治疗新策略
【字体: 大 中 小 】 时间:2025年07月12日 来源:npj Breast Cancer 6.6
编辑推荐:
本文聚焦三阴性乳腺癌(TNBC)治疗困境,针对ID4蛋白在基底样乳腺癌(BLBC)中的促癌机制不明问题,研究者通过CRISPR-Cas9基因编辑、小分子抑制剂AGX51干预及多组学分析,首次揭示ID4通过抑制BRCA1表达和激活ERK信号驱动肿瘤侵袭性,其靶向降解可诱导癌细胞向管腔样分化并恢复基因组稳定性。该研究为ID4高表达TNBC患者提供了精准治疗新靶点,AGX51的临床转化有望突破现有治疗瓶颈。
三阴性乳腺癌(TNBC)因缺乏雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)表达,成为乳腺癌中最具侵袭性的亚型,约占所有乳腺癌的15-20%。其典型特征包括早期转移倾向、化疗耐药性高、五年生存率不足30%,尤以基底样乳腺癌(BLBC)亚型预后最差。目前临床治疗主要依赖传统化疗,但约50%患者会出现远处转移。这种治疗困局的核心在于TNBC的高度异质性和关键驱动因子的认知空白。
近年研究发现,分化抑制因子ID4在BLBC中特异性高表达,与患者生存率显著负相关。该蛋白属于ID蛋白家族(ID1-ID4),作为转录调控因子通过抑制碱性螺旋-环-螺旋(bHLH)转录因子影响细胞分化。前期研究提示ID4可能通过破坏DNA损伤修复(如抑制BRCA1)加剧基因组不稳定性,但其在TNBC进展中的具体作用机制及治疗价值尚未系统阐明。
为破解ID4的促癌机制,阿根廷国立库约大学(Universidad Nacional de Cuyo)的研究团队设计了整合实验模型与临床数据的多平台研究:
基因编辑模型:利用CRISPR-Cas9技术构建ID4稳定敲除(KO)的MDA-MB-231细胞系(TNBC模型)
小分子靶向治疗:采用泛ID蛋白降解剂AGX51(40μM,72小时)处理细胞
临床队列验证:基于TCGA和Kaplan-Meier数据库分析ID4表达与生存率关联
多组学分析:通过转录组测序(RNA-seq)、基因集富集分析(GSEA)和转录因子活性解码(decoupleR包)解析分子机制
体内外功能验证:涵盖增殖(MTT)、克隆形成、迁移实验及NSG小鼠异种移植模型
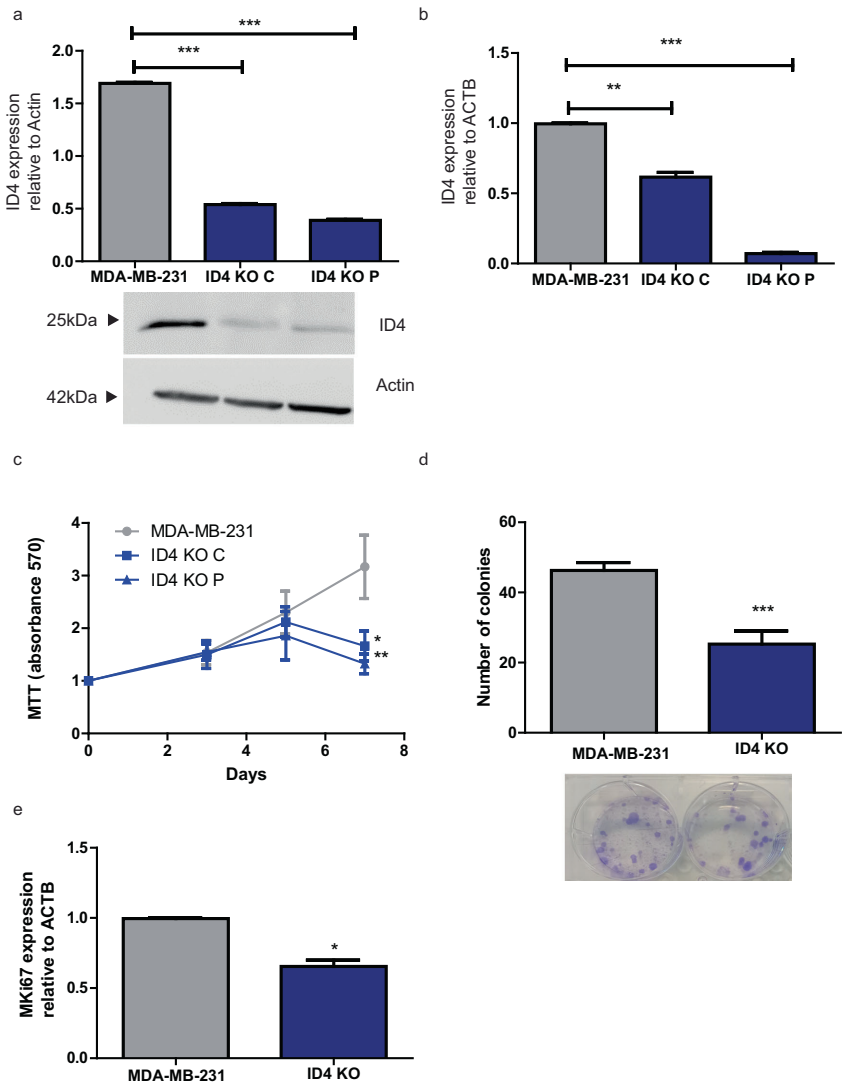
体外模型:ID4-KO细胞增殖率降低60%(MTT检测,p<0.001),克隆形成能力下降75%(图1c,d)
分子标志:增殖标记物Ki67表达下调2.8倍(图1e)
体内验证:NSG小鼠移植ID4-KO细胞后,肿瘤出现延迟60天,终体积仅为对照组的1/3(图2a左)
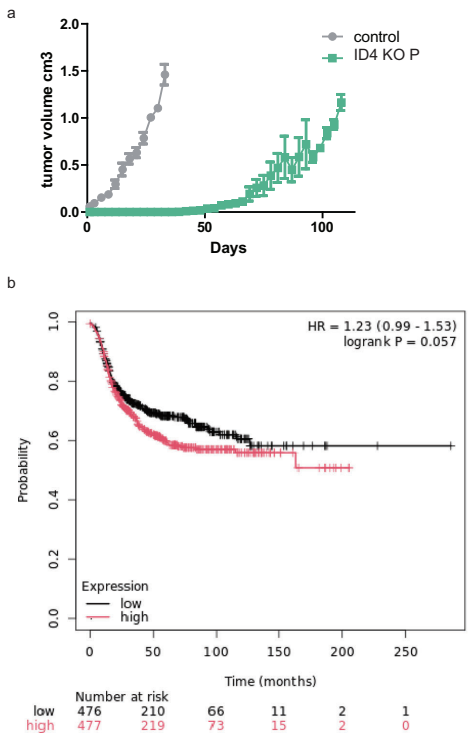
临床相关性:TCGA数据分析显示ID4低表达BLBC患者复发风险降低37%(Q1 vs Q4, p=0.004)(图2b)
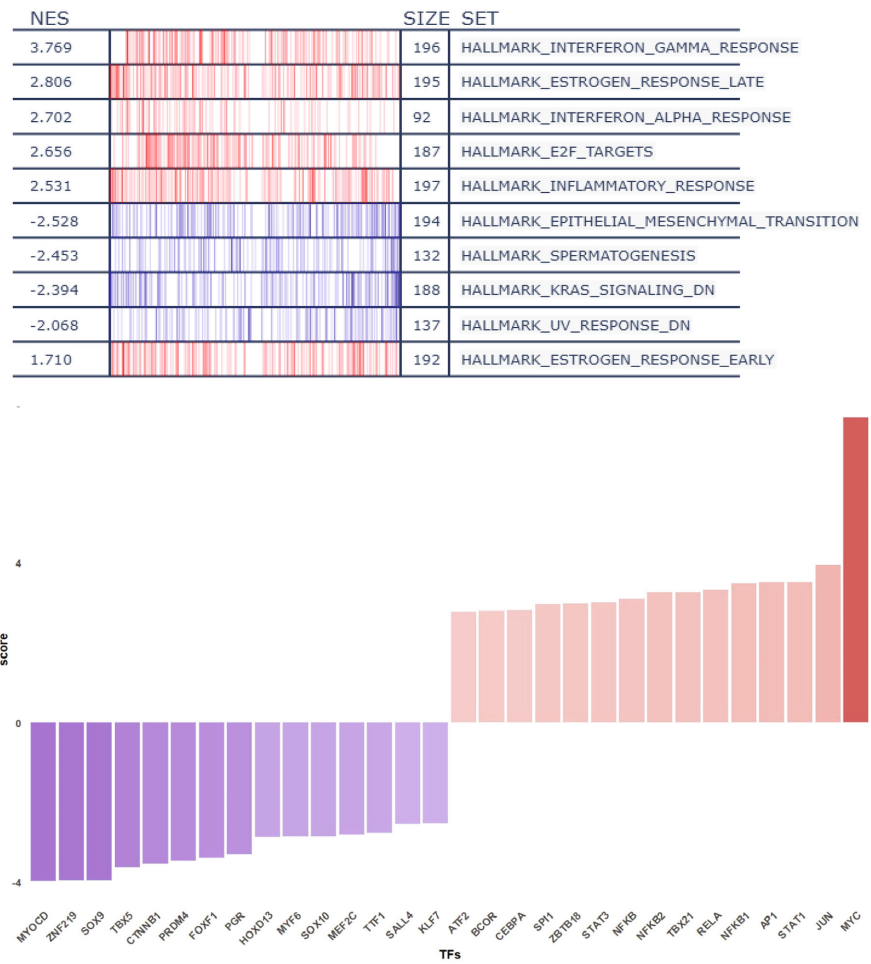
转录重编程:GSEA分析揭示低ID4组富集管腔型特征:
雌激素响应通路激活(NES=2.806, p=0.005)
干扰素反应增强(IFN-γ NES=3.769, p<0.001)
炎症信号上调(图3a)
关键调控因子:转录因子活性分析显示MYC、JUN、STAT1激活(促分化),SOX9/SOX10抑制(抑侵袭)(图3b)
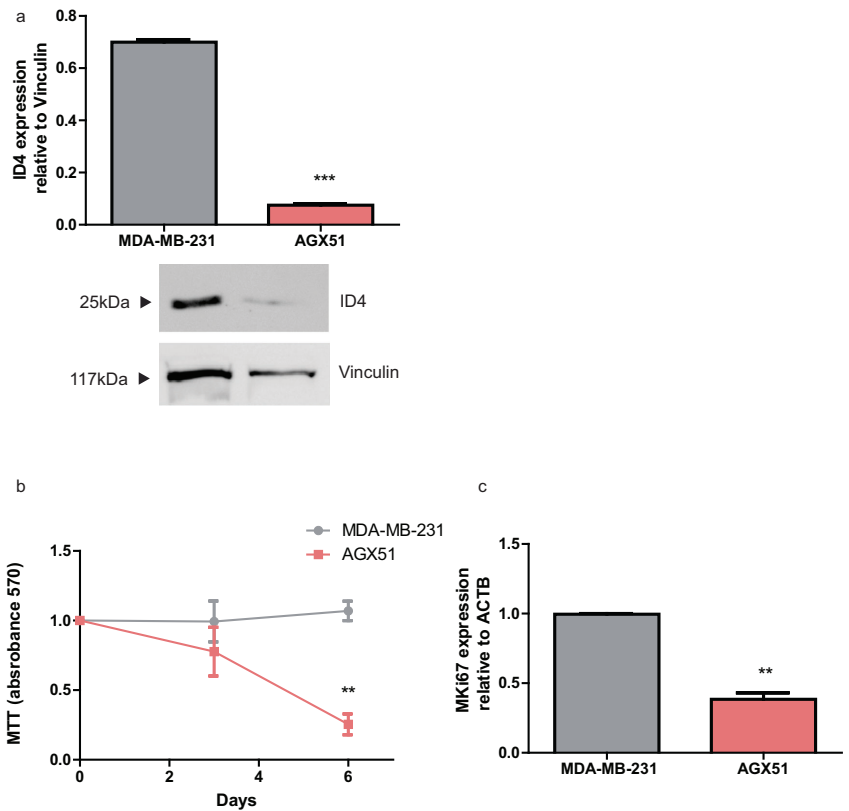
表型逆转:AGX51处理使细胞增殖率降低55%(图5b),Ki67表达下降2.5倍(图5c)
基因组稳定性修复:
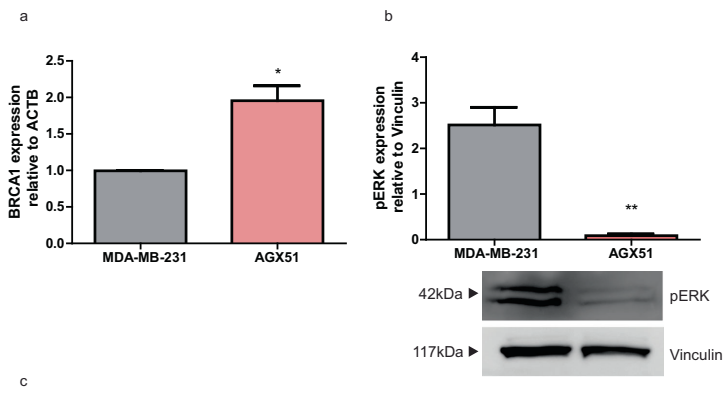
BRCA1蛋白表达恢复2.1倍(图6a)
细胞周期抑制因子p21CDKN1A显著上调
致癌信号阻断:磷酸化ERK(pERK)水平降低65%(图6b),抑制MAPK/ERK促存活通路
体内疗效:AGX51(15mg/kg)使小鼠肿瘤体积缩小50%(图6c),且未引发明显毒性
本研究通过多维验证确立ID4作为TNBC的核心驱动因子:
双重致癌机制:
维持基底样干性:通过抑制BRCA1表达诱发基因组不稳定性
激活促生存信号:增强ERK磷酸化驱动增殖侵袭
表型重塑效应:ID4缺失诱导TNBC向管腔样分化,表现为ERα/GATA3上调及雌激素响应通路激活
靶向治疗突破:AGX51通过降解ID4同时实现:
恢复BRCA1介导的DNA修复功能
阻断ERK致癌信号
诱导p21CDKN1A介导的细胞周期阻滞
值得关注的是,AGX51在临床前研究中展现出独特优势:
克服耐药性:靶向ID4蛋白降解策略避免传统抑制剂常见的获得性耐药
治疗精准化:ID4高表达可作为生物标志物筛选受益人群(约占TNBC的40%)
联合增效:前期研究提示AGX51与紫杉醇联用可协同消退转移灶
研究团队在讨论中提出转化方向:鉴于AGX51已证明良好安全性(60mg/kg剂量未见毒性),应优先推进ID4高表达TNBC患者的I期临床试验,并探索其与免疫检查点抑制剂的联合潜力——AGX51诱导的活性氧(ROS)增加可能增强肿瘤免疫原性。
这项发表于《npj Breast Cancer》的研究不仅解密了ID4的致癌网络,更提供了首个靶向该通路的临床级化合物AGX51,为攻克"乳腺癌之王"开辟了新路径。未来需在更多TNBC模型中验证疗效,并深入探索ID4调控分化与基因组稳定的表观遗传机制。
(全文约1980汉字)
 生物通微信公众号
生物通微信公众号
知名企业招聘