
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:可转移的CRISPR-Cas9方法在非模式昆虫中诱导基因组编辑:简明指南
【字体: 大 中 小 】 时间:2025年07月08日 来源:Frontiers in Zoology 2.6
编辑推荐:
这篇综述系统阐述了CRISPR-Cas9技术在非模式昆虫基因组编辑中的应用策略,重点介绍了sgRNA设计、Cas9递送方式(如ReMot/DiPa-CRISPR)、修复机制(NHEJ/HDR)及在害虫防控(如基因驱动gene drive、精准不育昆虫技术pgSIT)中的创新应用,为功能遗传学研究提供了跨物种可操作性框架。
细菌CRISPR(clustered regularly interspaced palindromic repeats)系统经改造后成为革命性的基因组编辑工具。其核心是Cas9核酸酶在sgRNA引导下靶向特定DNA序列,通过诱导双链断裂(DSB)激活细胞修复机制,实现基因敲除或精确修饰。这一技术突破了传统模式生物的限制,为昆虫功能遗传学开辟了新路径。
最基础的应用是通过NHEJ修复产生移码突变(图1A)。例如,在家蟋蟀(Acheta domesticus)中敲除眼色素基因vermilion可产生可见表型标记。更复杂的HDR修复则能实现精准编辑,如果蝇(Drosophila)中利用短单链寡核苷酸(ssODN)引入单碱基突变(图1C),或蜜蜂(Apis mellifera)中通过长同源臂整合荧光标记基因(图1E)。
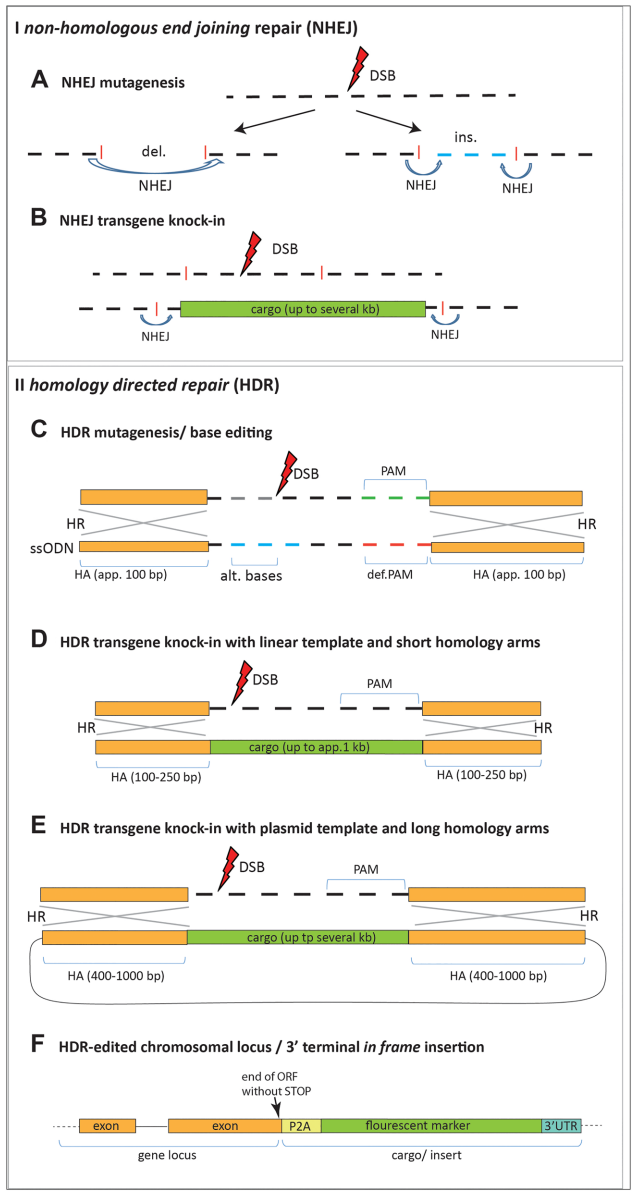
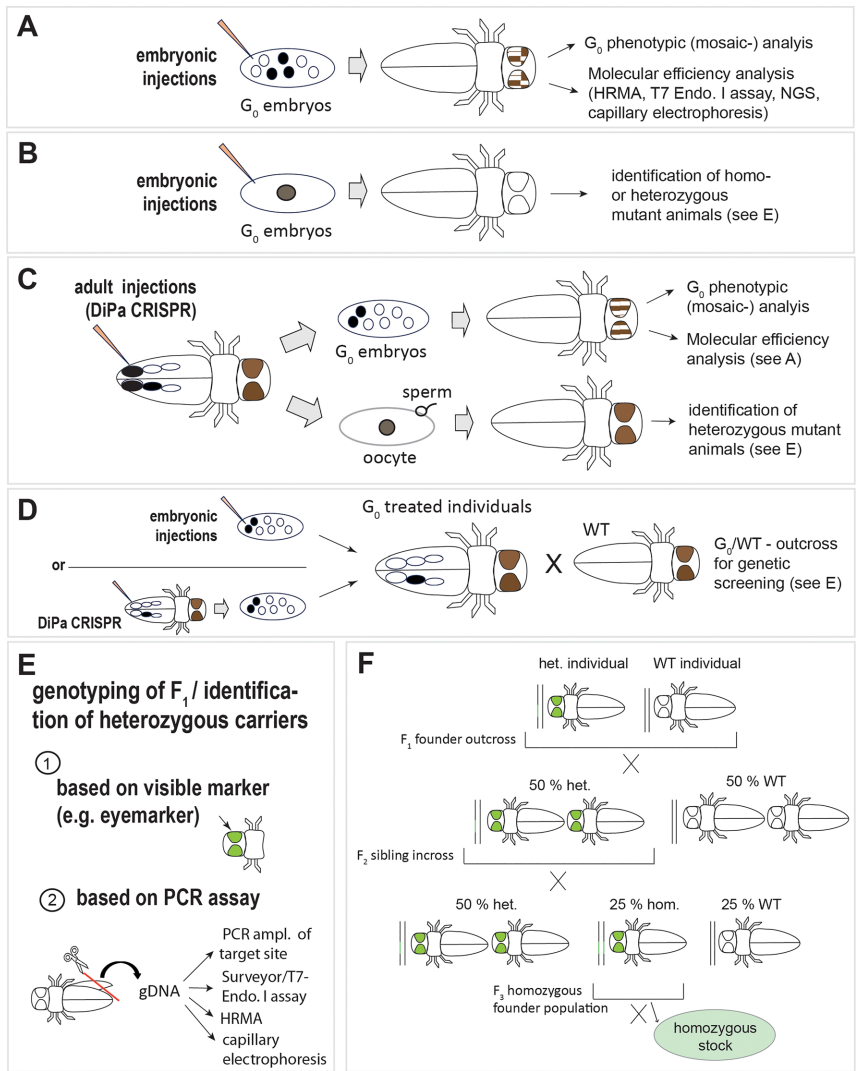
成功编辑需满足两大前提:目标基因组序列已知(需验证品系特异性多态性)及胚胎显微注射可行性。对于卵壳坚硬或体内发育的物种,可采用母体血淋巴注射技术(如DiPa-CRISPR),通过卵黄蛋白受体介导递送RNP复合物。
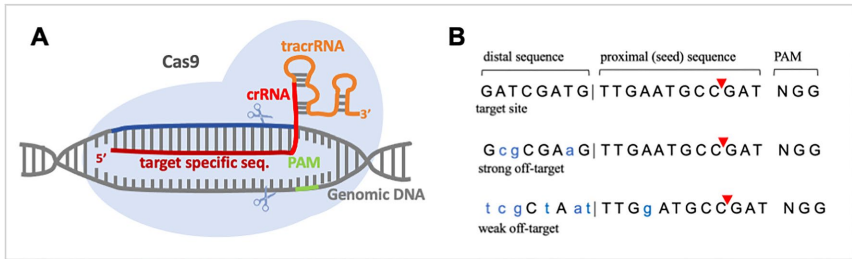
sgRNA的20nt引导序列与PAM(NGG)相邻(图2A)。种子序列(近PAM端12nt)的错配容忍度低,而远端8nt可容忍多碱基差异(图2B)。推荐使用CRISPR Optimal Target Finder等工具预测脱靶风险,并通过T7核酸内切酶I检测或高通量测序验证编辑效率。
除常规质粒注射外,受体介导的卵巢转导(ReMot)技术可将Cas9-sgRNA复合物递送至德国小蠊(Blattella germanica)等难操作物种。在赤拟谷盗(Tribolium castaneum)中,tRNA串联sgRNA系统使多重编辑效率提升3倍。
在疟蚊(Anopheles gambiae)中,针对doublesex基因的基因驱动可实现种群抑制(图4D)。而精准不育技术(pgSIT)通过敲除精子发生相关基因,已应用于苹果蠹蛾(Cydia pomonella)的田间防控。这些案例展示了CRISPR技术在解决公共卫生和农业问题中的巨大潜力。
当前HDR效率在部分物种(如赤拟谷盗)仍低于1%,需优化同源臂长度(建议400-1000bp)和修复模板化学修饰。新兴的Cas12a系统因其T-rich PAM特性,可能为NHEJ介导的片段插入提供新选择。随着更多物种特异性启动子(如果蝇hsp70、家蟋蟀U6)的鉴定,CRISPR工具箱将进一步完善,推动非模式昆虫研究进入精准调控时代。
 生物通微信公众号
生物通微信公众号
知名企业招聘