
-

生物通官微
陪你抓住生命科技
跳动的脉搏
乳酸副干酪乳杆菌中Cas9非依赖性tracrRNA的细胞毒性机制研究
【字体: 大 中 小 】 时间:2025年07月04日 来源:microLife 3.1
编辑推荐:
本研究揭示了CRISPR-Cas9系统中tracrRNA短亚型(tracr-S)在乳酸副干酪乳杆菌(Lacticaseibacillus paracasei)中独立于Cas9的细胞毒性作用。研究人员通过构建系列质粒载体,发现tracr-S通过其anti-repeat和nexus区域与宿主RNA相互作用导致细胞毒性,并鉴定出转录调控因子Peg.728参与调控tracr-L表达。该研究为CRISPR-Cas9系统在非原生宿主中的应用提供了重要参考,发表于《microLife》。
在基因组编辑领域,CRISPR-Cas9系统因其精准的DNA切割能力已成为革命性工具。然而,当这些系统被引入非原生宿主时,常常面临意想不到的挑战。其中,来自化脓链球菌(Streptococcus pyogenes)的Cas9(SpyCas9)蛋白的细胞毒性已被广泛报道,但其他系统组分的潜在毒性却鲜为人知。这项由Helmholtz感染研究中心等机构完成的研究,首次揭示了CRISPR-Cas9系统中一个被忽视的"暗物质"——转激活CRISPR RNA(tracrRNA)的独立毒性作用。
研究人员主要采用了以下关键技术方法:1) 质粒构建与细菌转化,通过系列质粒设计解析毒性元件;2) Northern blot分析tracrRNA亚型表达;3) MS2亲和纯化偶联RNA测序(MAPS)鉴定tracrRNA相互作用靶标;4) 全基因组测序分析逃逸突变体;5) IntaRNA预测RNA-RNA相互作用。使用的乳酸菌样本包括L. paracasei B株及ATCC标准菌株。
研究结果部分:
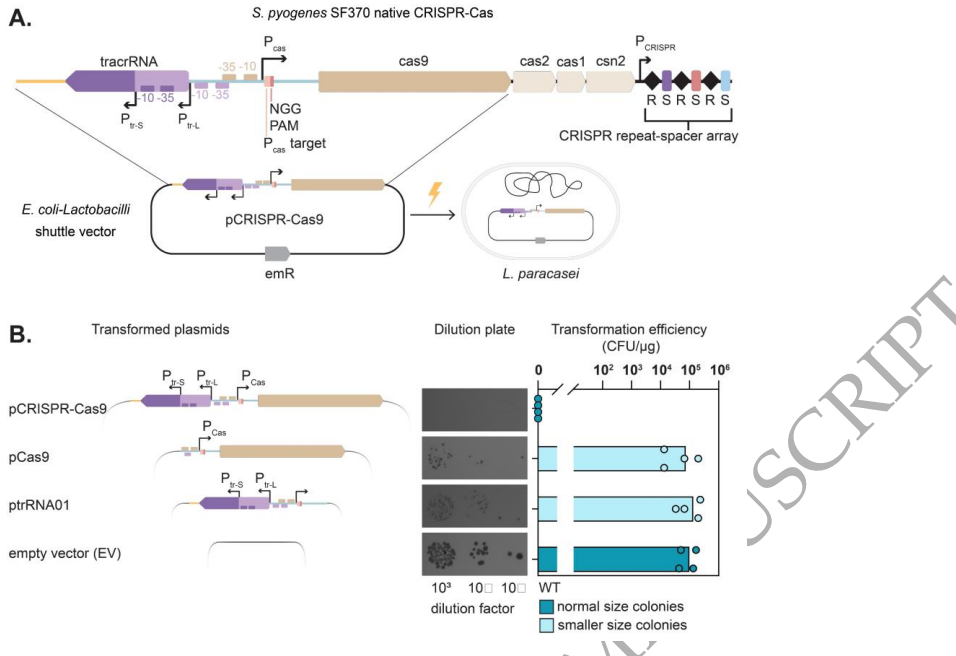
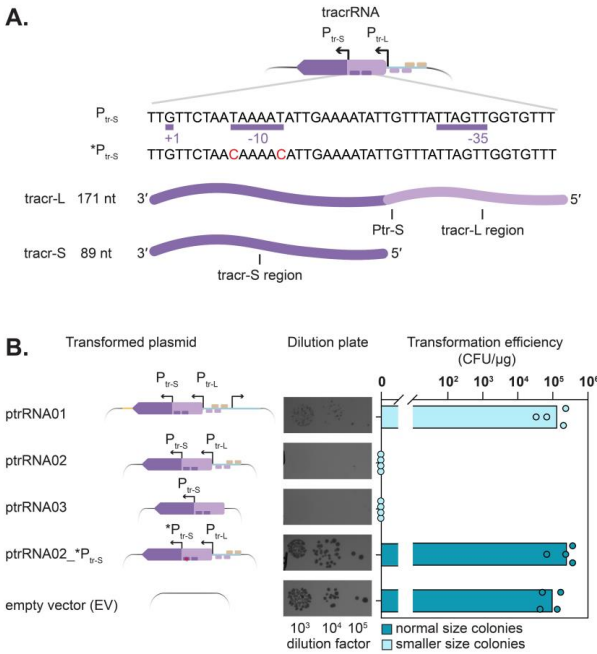
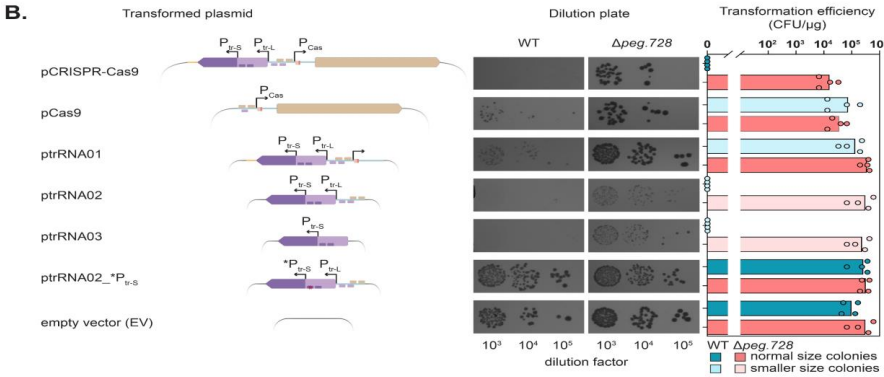
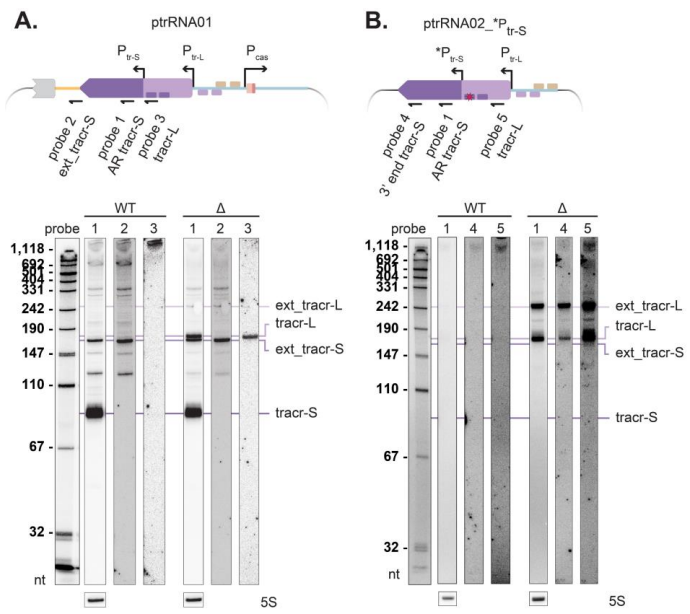
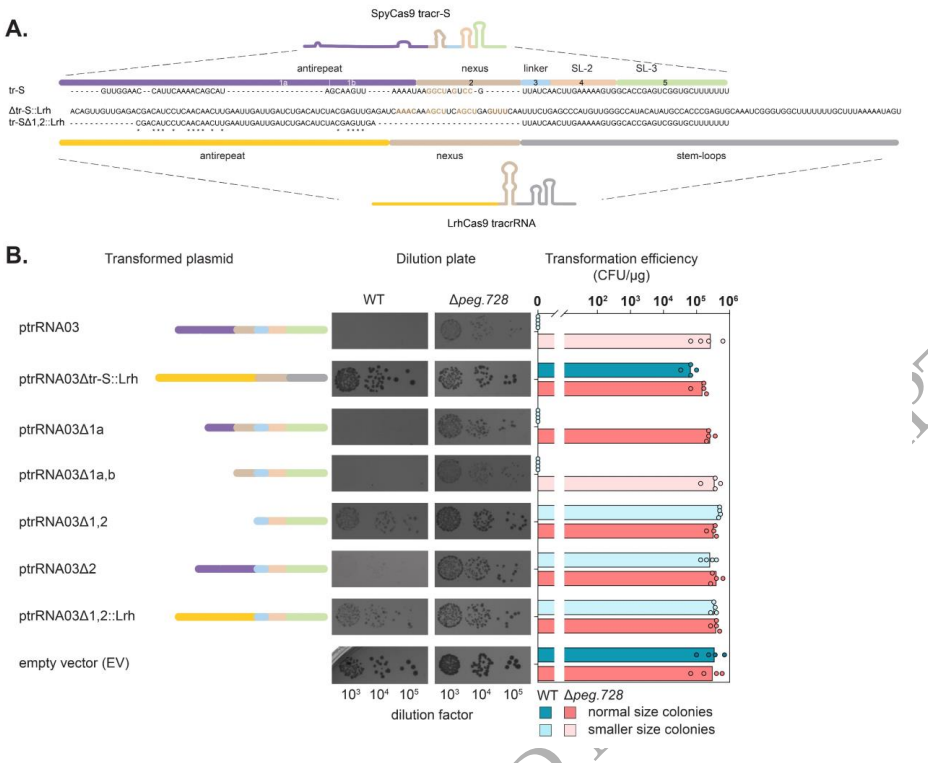
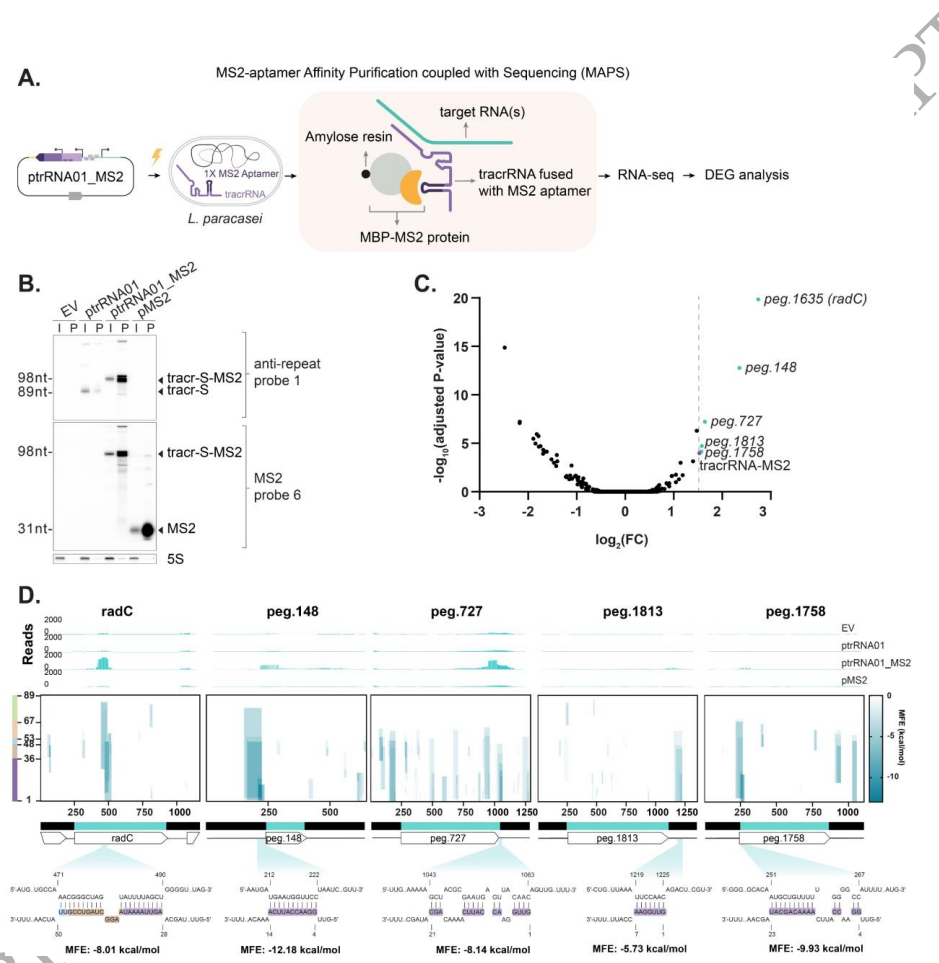
这项研究首次系统揭示了CRISPR-Cas9系统中tracrRNA的独立毒性作用机制。研究发现tracr-S通过其特定序列区域与宿主RNA相互作用导致细胞毒性,而宿主转录调控因子Peg.728通过抑制tracr-L表达参与这一过程。这些发现不仅解释了为何某些细菌中异源表达CRISPR-Cas9系统特别困难,也为优化基因编辑工具在非原生宿主中的应用提供了重要指导。特别值得注意的是,tracrRNA与宿主RNA的意外相互作用可能代表了CRISPR-Cas系统进化过程中的选择压力,这为理解CRISPR免疫系统的进化提供了新视角。该研究强调在应用CRISPR技术时,除关注Cas蛋白外,还需全面考虑所有系统组分的潜在影响。
 生物通微信公众号
生物通微信公众号
知名企业招聘