
-

生物通官微
陪你抓住生命科技
跳动的脉搏
揭示UBA6作为VEXAS综合征治疗新靶点:基于UBA1M41V突变细胞模型的机制与转化研究
【字体: 大 中 小 】 时间:2025年07月01日 来源:Leukemia 12.8
编辑推荐:
本研究针对VEXAS综合征(一种由UBA1M41突变引发的高炎症性骨髓衰竭疾病)的治疗困境,通过构建UBA1M41V突变THP1细胞模型,首次发现UBA6依赖性补偿机制。研究证实E1抑制剂TAK-243通过选择性抑制UBA6显著清除突变克隆,而植物源性化合物植酸(IP6)可特异性靶向UBA6,为临床干预提供新策略。论文发表于《Leukemia》,为这类缺乏有效疗法的致死性疾病开辟了精准治疗路径。
研究背景与科学问题
VEXAS综合征(Vacuoles, E1-enzyme, X-linked, Autoinflammatory, Somatic)是近年来新发现的获得性造血系统疾病,以全身性炎症、进行性骨髓衰竭和高死亡率为特征。该疾病的分子标志是UBA1基因第41位甲硫氨酸(M41)的体细胞突变,导致细胞质UBA1b亚型缺失和异常截短亚型UBA1c的产生。尽管突变机制明确,但UBA1功能失调如何驱动疾病发生仍是未解之谜。更严峻的是,目前临床仅依赖糖皮质激素控制症状,缺乏针对致病克隆的特异性治疗手段。
研究设计与技术方法
美国辛辛那提儿童医院医学中心的研究团队通过CRISPR/Cas9和腺相关病毒(AAV)技术,在男性单核细胞白血病THP1细胞系中构建UBA1M41V等基因突变模型。采用多组学分析(转录组、蛋白质组、泛素化修饰组)、功能丧失实验(shRNA敲低)和小分子抑制剂干预(TAK-243、植酸)等策略,结合体外竞争实验和小鼠异种移植模型,系统解析突变细胞的分子特征与治疗靶点。
主要研究结果
1. 成功构建VEXAS综合征细胞模型
通过精确编辑UBA1基因引入M41V突变,证实突变细胞呈现典型病理特征:
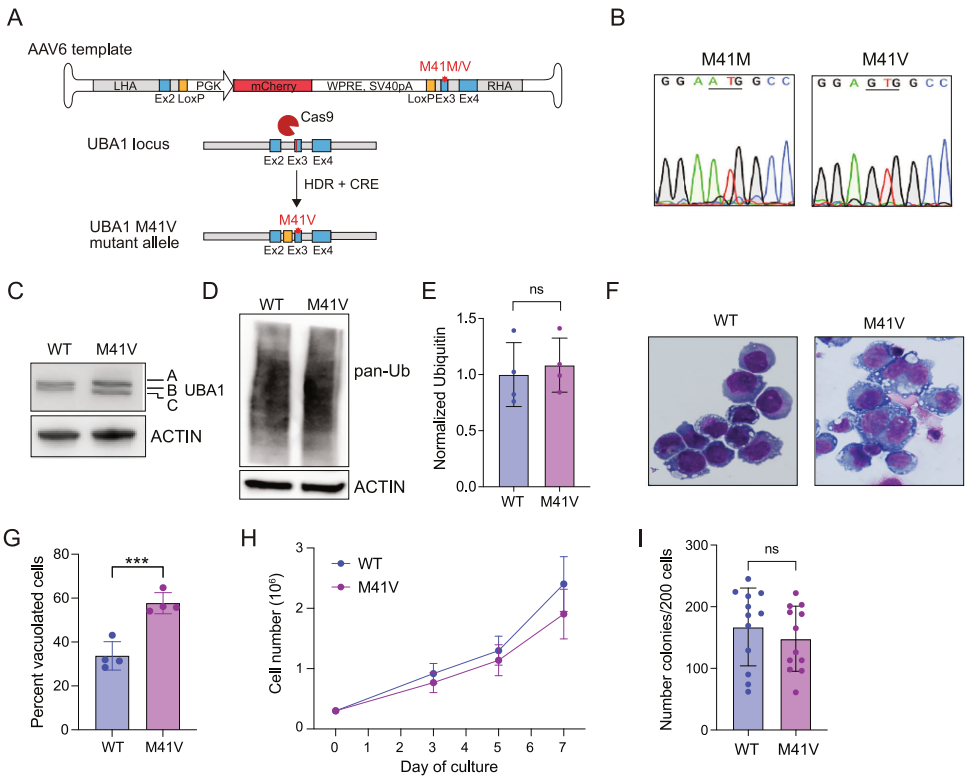
2. 多组学揭示炎症与蛋白稳态失衡
3. E1酶抑制的差异化效应
4. UBA6作为新型治疗靶点
结论与意义
该研究突破性地揭示了VEXAS综合征的双重病理机制:UBA1突变不仅直接破坏泛素化稳态,还通过诱导UBA6依赖性补偿创造治疗窗口。研究发现:
研究同时提出未解问题:UBA6底物FAT10(泛素样蛋白)是否参与疾病进程?这为后续研究指明方向。论文的模型系统与发现已被《Leukemia》审稿人评价为"填补了VEXAS机制研究与治疗开发的关键空白"。
 生物通微信公众号
生物通微信公众号
知名企业招聘