
-

生物通官微
陪你抓住生命科技
跳动的脉搏
靶向SCFSkp2 E3泛素连接酶复合体的精准扰动策略:揭示p27-Cks1反馈环路在Rb1/Trp53缺失前列腺癌治疗中的关键作用
【字体: 大 中 小 】 时间:2025年02月23日 来源:Communications Biology 5.2
编辑推荐:
本研究针对RB1缺失肿瘤缺乏靶向疗法的难题,通过基因编辑技术构建Cks1N45R突变小鼠模型,系统比较了SCFSkp2复合体不同亚基靶向干预对Rb1/Trp53双缺失前列腺癌的抑制效果。研究发现Cks1N45R通过阻断Skp2-Cks1相互作用完全抑制肿瘤发生,其效果等同于Skp2敲除,而传统p27T187A突变仅能延缓进展。研究首次揭示p27与Skp2存在双向负反馈调控,为RB1缺失肿瘤提供了特异性治疗靶点。论文发表于《Communications Biology》。
在肿瘤生物学领域,RB1基因的缺失或突变常与最具侵袭性的癌症类型相关联,包括转移性去势抵抗性前列腺癌(mCRPC)和小细胞肺癌等。这些肿瘤对现有疗法极易产生耐药性,患者生存率极低。问题的核心在于:当细胞失去这个关键的"分子刹车"RB1后,如何找到只针对癌细胞而不伤害正常细胞的精准打击策略?以往研究表明,SCFSkp2 E3泛素连接酶可能是RB1缺失肿瘤的致命弱点,但如何安全有效地靶向这个由11个亚基组成的复杂分子机器仍是未解难题。
爱因斯坦医学院(Albert Einstein College of Medicine)的研究团队在《Communications Biology》发表的研究给出了创新解决方案。他们另辟蹊径,不是直接靶向SCFSkp2核心组件,而是精准破坏其"左膀右臂"——辅助蛋白Cks1与Skp2的握手部位。通过冷冻电镜结构指导,团队设计出能精确模拟药物作用的Cks1N45R基因突变小鼠,并与传统p27T187A突变策略进行头对头比较,揭开了这个分子机器运作的奥秘。
研究采用多组学技术联合作战:通过CRISPR/Cas9构建Cks1N45R/N45R基因敲入小鼠模型;利用9.4T小动物MRI动态监测前列腺肿瘤进展;结合免疫共沉淀和蛋白质稳定性分析揭示Skp2-p27双向调控机制;采用流式细胞术分析细胞周期阻滞效应。所有实验均在Rb1lox/lox;Trp53lox/lox双敲除背景的小鼠胚胎成纤维细胞(MEFs)和原代前列腺癌细胞中进行验证。
在Rb1/Trp53双敲除(RP-DKO)前列腺癌模型中,Cks1N45R突变展现出惊人的肿瘤抑制效果:39只基因编辑小鼠中仅1例出现肿瘤,20个月生存率>90%,完全复制了Skp2敲除的效果。相比之下,p27T187A突变组38只小鼠全部发生肿瘤,仅略微延缓进展。在Rb1单等位基因缺失导致的垂体瘤模型中,Cks1N45R同样展现出100%的保护作用。
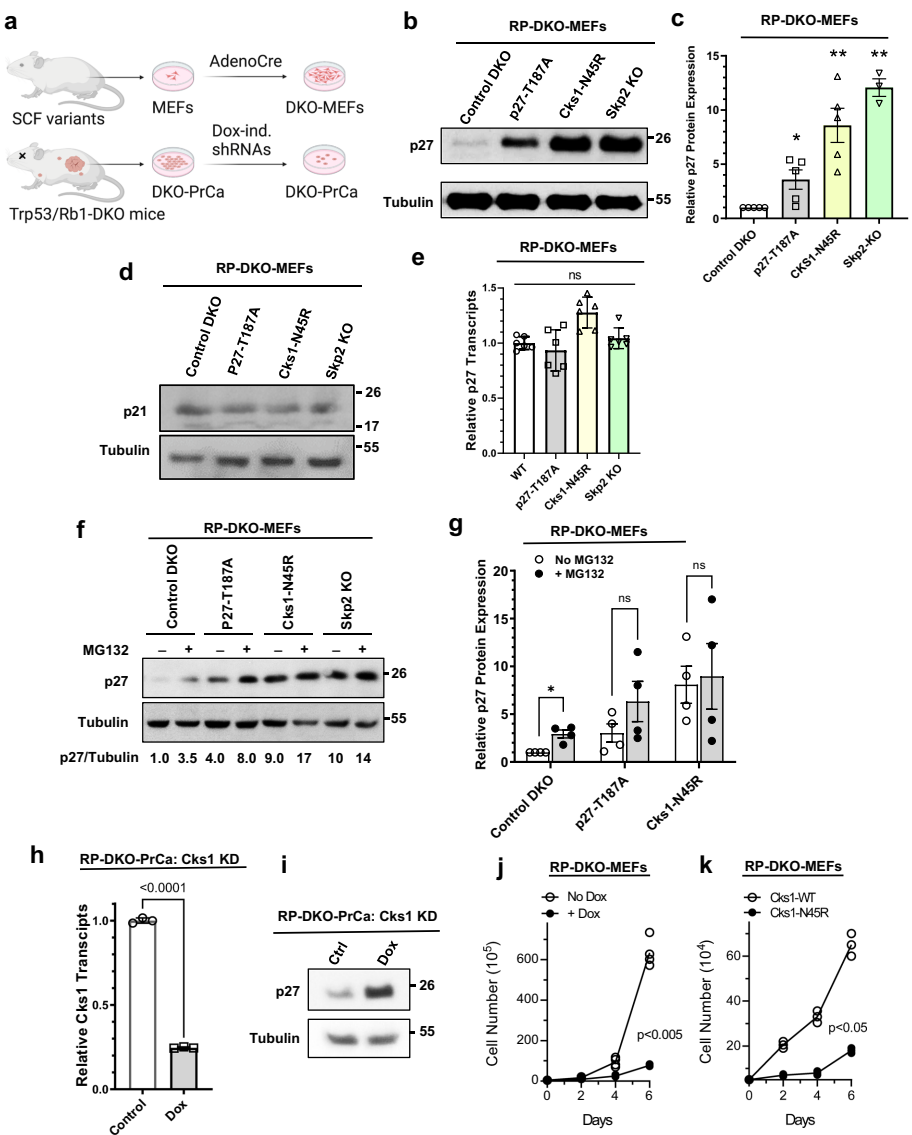
结构生物学模型显示,Cks1第45位天冬酰胺突变为精氨酸(N45R)会破坏其与Skp2的相互作用口袋,导致SCFSkp2-Cks1-Cdk2-cyclinA-p27高阶复合体无法组装。免疫共沉淀证实Cks1N45R完全丧失Skp2结合能力,而p27T187A仍可通过cyclinA间接结合SCF复合体。蛋白质稳定性实验显示,Cks1N45R使p27蛋白水平提升9倍(接近Skp2敲除的11倍),而p27T187A仅增加3.5倍。
研究揭示p27积累会加速Skp2降解:在Cks1N45R细胞中,Skp2半衰期从16小时骤降至1.9小时。机制研究表明,高浓度p27会竞争性取代Skp2与cyclinA的结合,暴露出Skp2的N端降解信号,促进APC/CCdh1介导的泛素化降解。这种双向负反馈形成分子开关,解释了为何部分抑制(p27T187A)与完全阻断(Cks1N45R)效果差异显著。
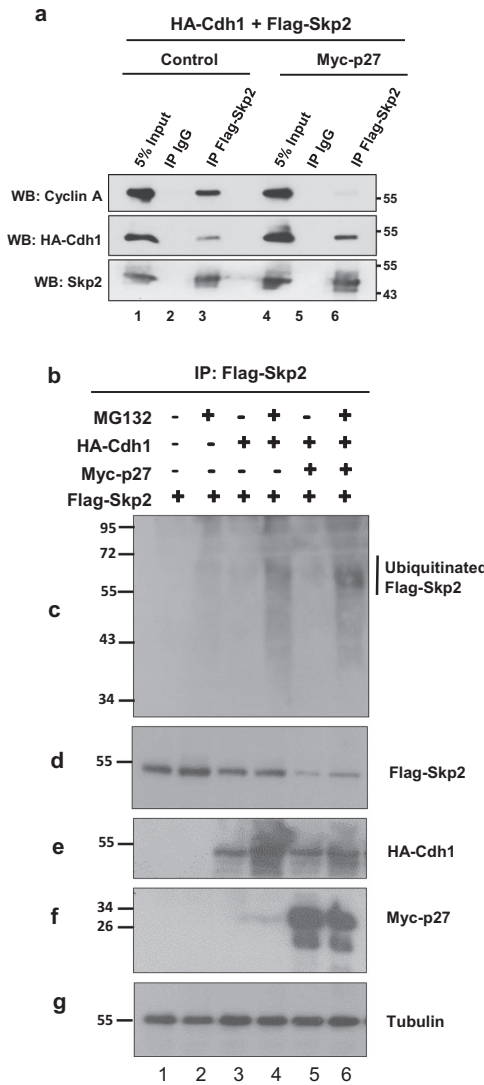
该研究突破性地证明:靶向SCFSkp2复合体的"非催化口袋"——Skp2-Cks1蛋白相互作用界面,可特异性阻断RB1缺失肿瘤进展。相比直接抑制E3泛素连接酶活性,这种策略避免了全局性蛋白稳态破坏,具有更好的安全性。发现的p27-Skp2双向负反馈为理解细胞周期调控提供了新范式,Cks1N45R突变体可作为药物开发的黄金标准模型。研究建立的"结构指导-基因编辑-动物验证"研究框架,为其他多亚基复合体的靶向治疗开发提供了范本。
值得注意的是,虽然小分子抑制Skp2-Cks1相互作用仍面临挑战,但该研究明确提示:成功的抑制剂应能破坏界面结合而非单纯阻断磷酸化识别,这为药物设计指明了方向。对于约占mCRPC 39%的RB1/TP53共缺失患者群体,这项研究带来了精准治疗的新希望。
 生物通微信公众号
生物通微信公众号
知名企业招聘