
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基于微尺度热泳技术的RNA甲基转移酶活性检测新方法助力DNMT2抑制剂发现
【字体: 大 中 小 】 时间:2025年02月05日 来源:Communications Chemistry 5.9
编辑推荐:
本研究针对RNA甲基转移酶(MTase)药物研发中检测技术通量低、成本高的瓶颈问题,开发了一种基于分裂适配体的微尺度热泳(MST)检测方法。研究人员通过改造天然metH核糖开关适配体,构建了可特异性识别S-腺苷同型半胱氨酸(SAH)的荧光生物传感器,成功应用于METTL3/14、DNMT2、NSUN2和S. aureus TrmD等多种RNA MTase的酶活检测与抑制剂筛选。该方法具有非专利、高灵敏度(检测限<50 nM)和低成本(<0.05美元/反应)优势,并通过DNMT2抑制剂筛选发现多个微摩尔级活性化合物,为表观遗传药物开发提供了新工具。
在RNA表观遗传学研究如火如荼的今天,RNA甲基化修饰作为调控基因表达的关键机制,已成为抗癌和抗感染药物开发的新靶点。然而这个领域长期面临一个技术瓶颈:现有RNA甲基转移酶(MTase)活性检测方法要么依赖昂贵的质谱或放射性标记,要么受限于商业试剂盒的高成本(5美元/反应),严重制约了药物筛选效率。面对这一挑战,德国美因茨大学医学中心的研究团队在《Communications Chemistry》发表创新成果,他们巧妙改造细菌天然SAH核糖开关,开发出革命性的微尺度热泳检测技术,为RNA甲基化研究开辟了新途径。
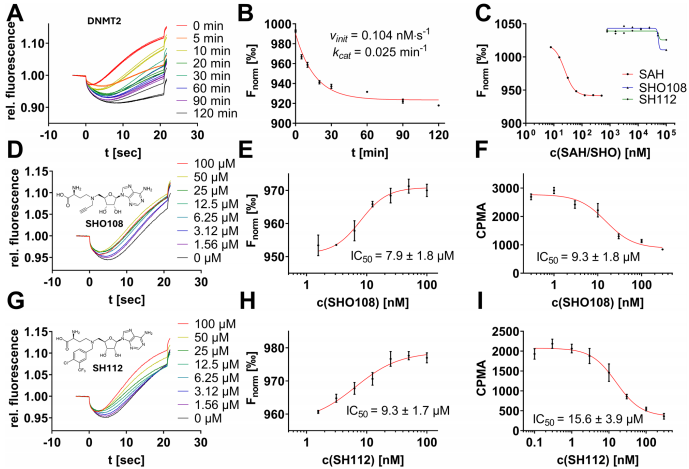
研究团队采用分裂适配体策略,将68nt的metH核糖开关适配体在A50位点拆分,分别标记FAM/TAMRA荧光团构建生物传感器。通过系统优化建立了MST和FRET双平台检测体系,其中MST方案展现出41dB信噪比和0.84 Z因子,灵敏度达24nM。该方法成功应用于DNMT2、METTL3/14等四种MTase的酶动力学研究,并完成240个化合物的筛选,发现包括alexidine(KD=364μM)和adamantanyl-acryloylurea(IC50=4.1μM)在内的新型抑制剂。
关键技术包括:1)基于天然metH核糖开关设计分裂适配体生物传感器;2)建立微尺度热泳(MST)和荧光共振能量转移(FRET)双检测平台;3)开发适用于DNMT2、METTL3/14等不同MTase的标准化反应体系;4)采用荧光偏振(FP)和电泳迁移率(EMSA)进行正交验证;5)开展共价和非共价化合物库筛选。

设计与校准FRET/MST兼容的SAH分裂适配体
通过截短D. aromatica的metH核糖开关(去除P3茎),团队获得对SAH具有20nM亲和力的核心序列。分裂设计后,aptaSAH1/2在MST平台展现24nM KD值和300倍SAH/SAM选择性,显著优于FRET方案(33dB信噪比)。与商业AptaFluor试剂盒相比,该方案成本降低100倍且公开所有序列信息。
RNA MTase活性表征与抑制研究
在DNMT2模型中,该方法成功重现文献报道的慢动力学特征(kcat=0.025 min-1),并验证SHO108/SH112抑制剂的μM级活性。对METTL3/14的检测显示5.1nM STM2457抑制常数,与抗体法结果一致。针对热不稳定NSUN2,发现4℃无BSA保存可维持14天活性,解决了该酶的应用难题。
DNMT2抑制剂筛选发现
通过160化合物表观遗传库筛选,发现alexidine能可逆竞争SAH结合位点(FP验证),而其他9个hit化合物通过破坏DNMT2-tRNA相互作用发挥抑制(EMSA证实)。80化合物共价库筛选则发现靶向Cys-79的adamantanyl-acryloylurea,其时间依赖性抑制表明共价作用机制。
这项研究突破性地解决了RNA MTase研究领域的关键技术瓶颈。所开发的MST检测方案不仅灵敏度媲美商业试剂盒,更通过完全公开适配体序列和<0.05美元/反应的成本,极大降低了研究门槛。特别值得注意的是,该方法成功应用于从人源DNMT2到细菌TrmD的多种MTase,展现出广泛的适用性。发现的DNMT2抑制剂为开发靶向tRNA修饰的抗癌药物提供了新起点,而建立的NSUN2稳定化方案则为相关研究扫清了技术障碍。这项工作从方法学创新到实际应用均体现出高度价值,将显著推动RNA表观遗传学和相关药物研发进程。

 生物通微信公众号
生物通微信公众号
知名企业招聘