
-

生物通官微
陪你抓住生命科技
跳动的脉搏
特征选择性抑制机制通过皮质微环路实现预期抑制
《Scientific Reports》:Feature selective inhibitory mechanisms enable expectation suppression in cortical microcircuits
【字体: 大 中 小 】 时间:2025年12月03日 来源:Scientific Reports 3.9
编辑推荐:
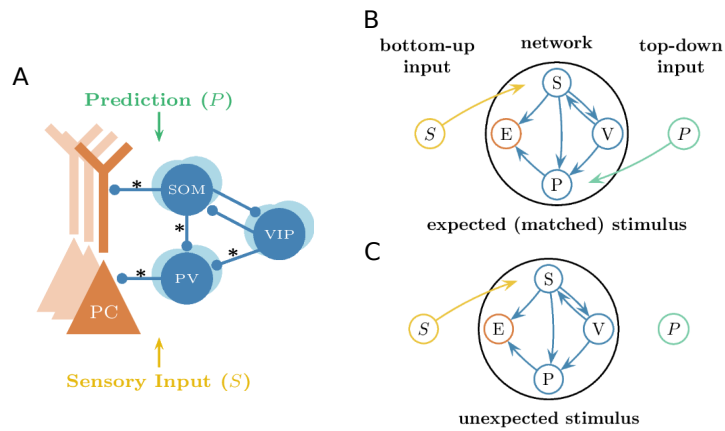
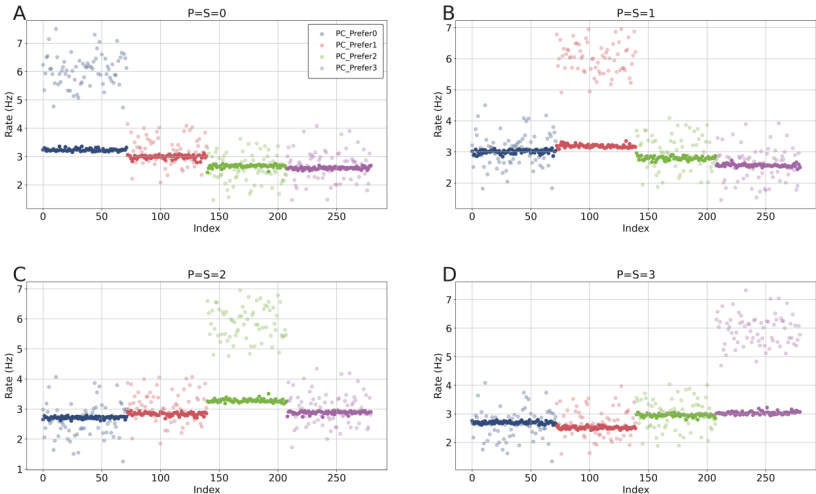
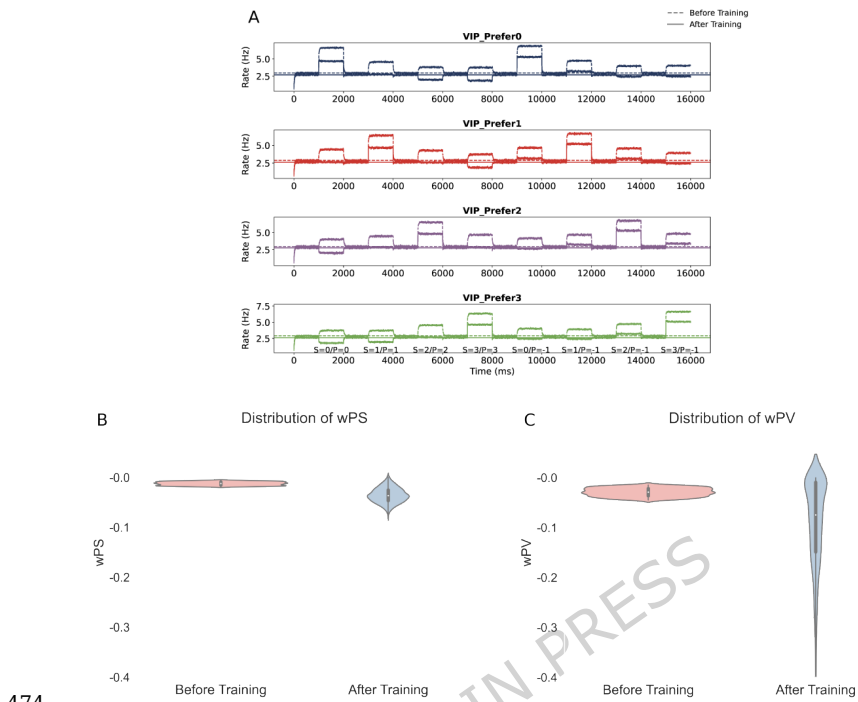
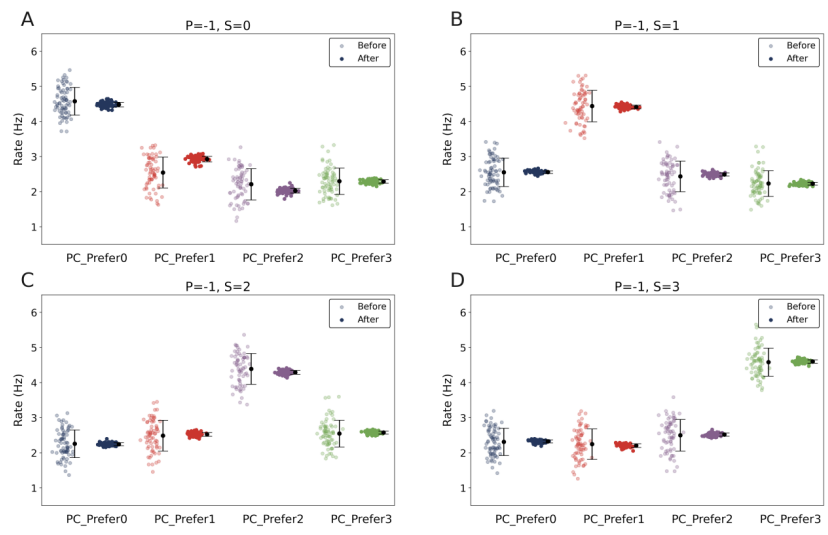
本文推荐:为揭示预期抑制(ES)的神经环路机制,研究人员构建了包含兴奋性锥体细胞(PCs)和三种抑制性中间神经元(PV、SOM、VIP)的计算模型。研究发现SOM神经元通过特征特异性树突抑制介导预期刺激下的选择性抑制,而VIP神经元通过抑制PV神经元实现去抑制,增强对意外刺激的反应。该研究阐明了抑制性神经元多样性、突触可塑性和特征选择性在预测性编码中的协同作用。
 生物通微信公众号
生物通微信公众号
知名企业招聘