
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:被激怒:α-半乳糖综合征发病机制中的过敏效应细胞
《Current Allergy and Asthma Reports》:Ticked Off: Allergic Effector Cells in the Pathogenesis of Alpha-gal Syndrome
【字体: 大 中 小 】 时间:2025年11月30日 来源:Current Allergy and Asthma Reports 4.6
编辑推荐:
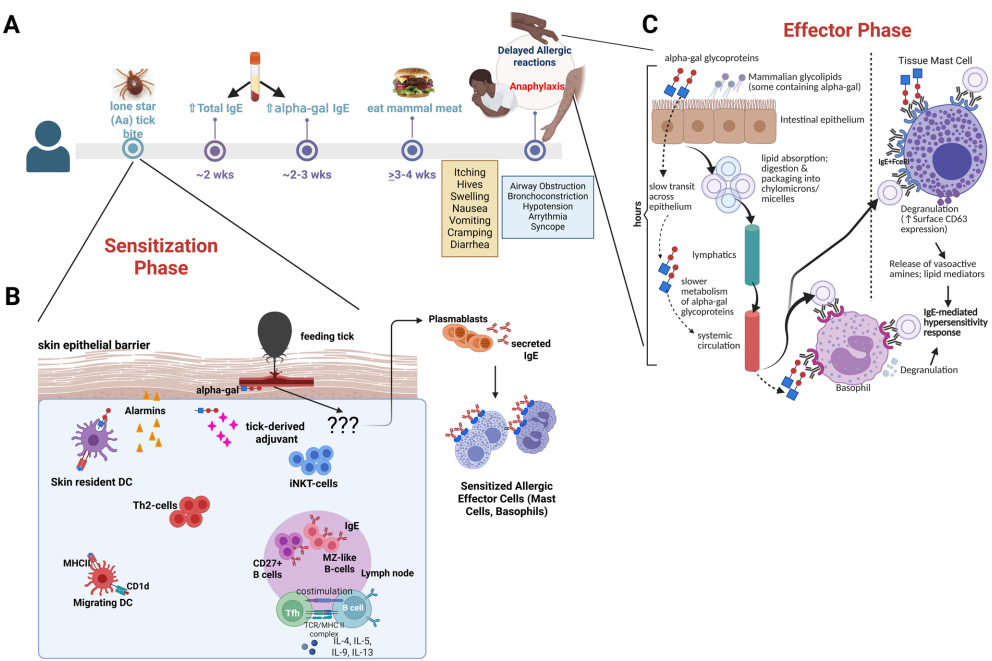
本综述系统阐述了α-半乳糖综合征(Alpha-gal Syndrome, AGS)这一由蜱虫叮咬引发的、针对哺乳动物肉中α-半乳糖(alpha-gal或a-Gal)糖基的迟发性过敏反应的临床特征、流行病学、诊断及免疫学机制。文章重点聚焦于肥大细胞(Mast Cells, MCs)和嗜碱性粒细胞在AGS致敏阶段和效应阶段的核心作用,并探讨了症状延迟出现、反应不一致性等独特临床现象背后的潜在细胞与分子机制,为理解这一新型食物过敏提供了最新视角。
 生物通微信公众号
生物通微信公众号
知名企业招聘