
-

生物通官微
陪你抓住生命科技
跳动的脉搏
肠道T细胞淋巴瘤分子分型新突破:SETD2功能丧失与H3-3A/B突变驱动MEITL,JAK-STAT通路异质性揭示靶向治疗新策略
【字体: 大 中 小 】 时间:2025年10月08日 来源:Leukemia 13.4
编辑推荐:
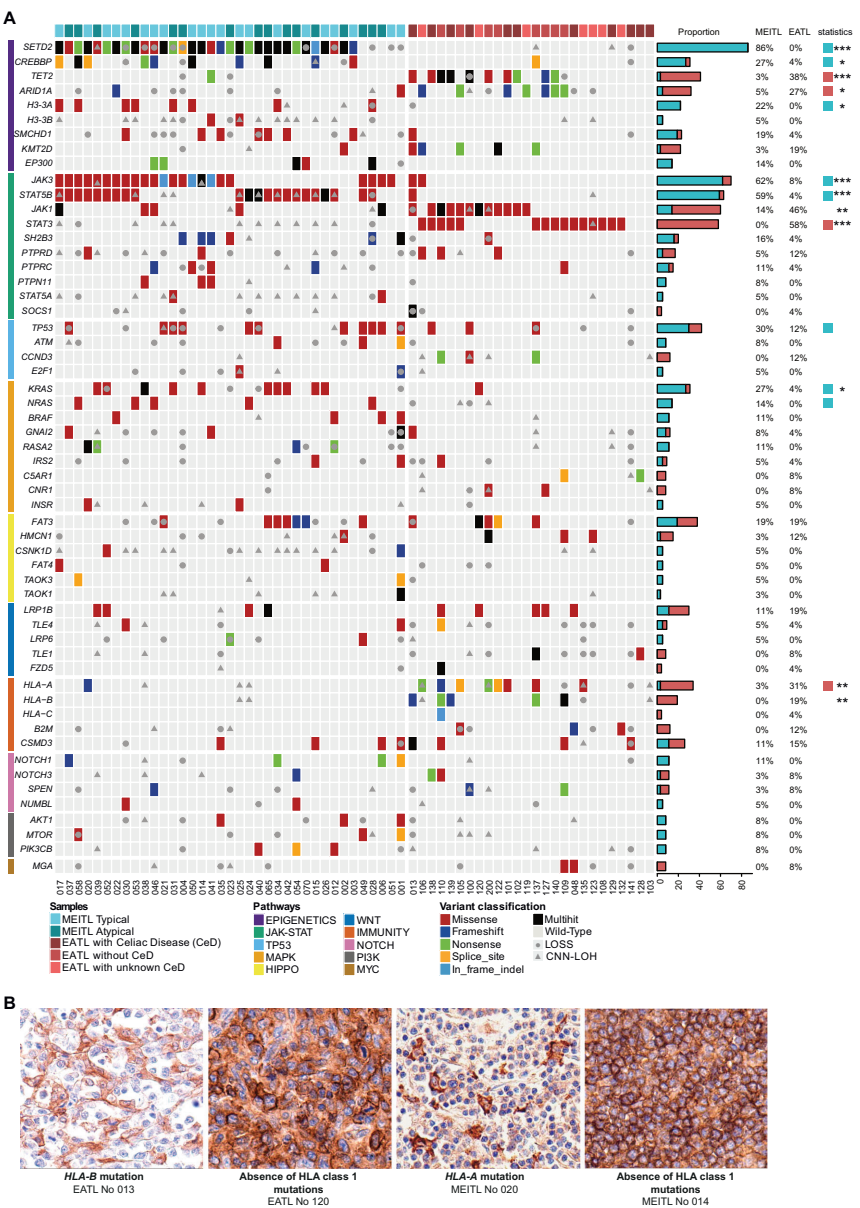
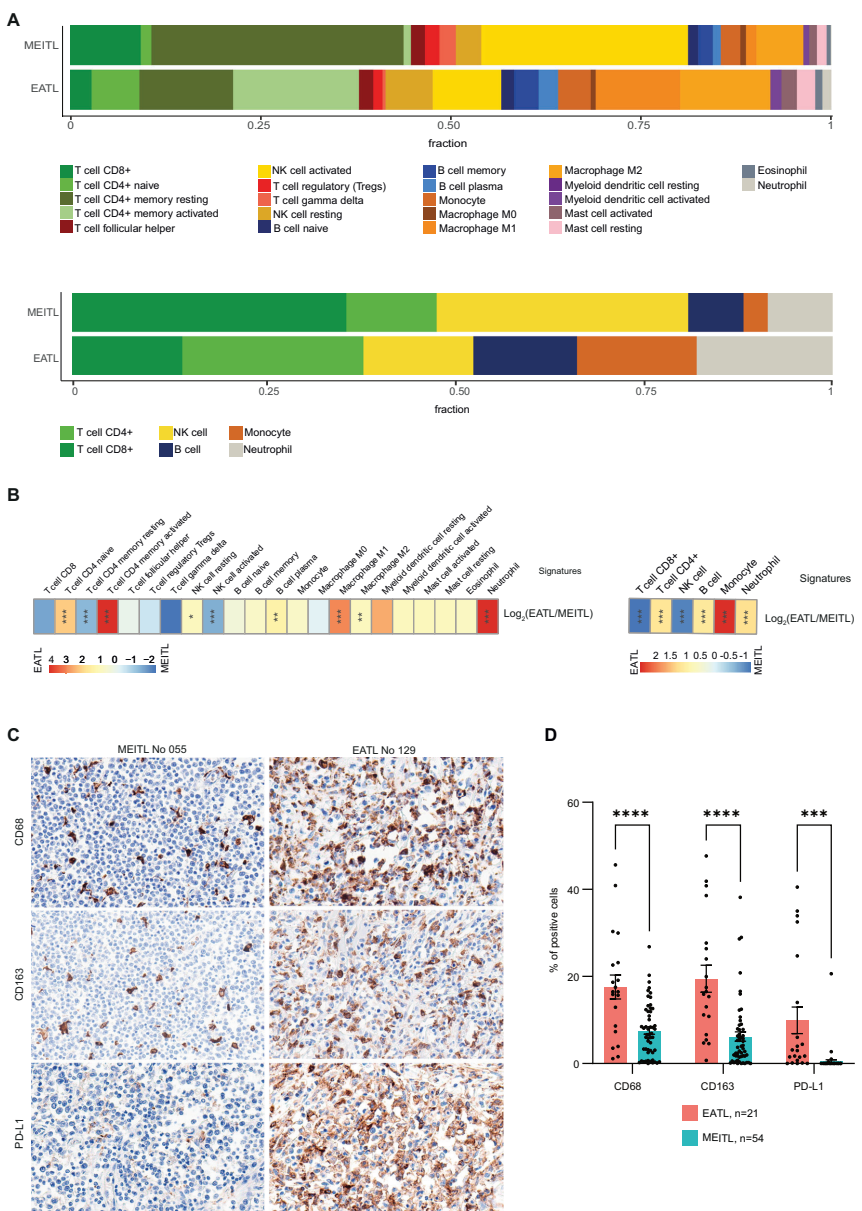
本研究针对肠病相关性T细胞淋巴瘤(EATL)和单形性亲上皮性肠道T细胞淋巴瘤(MEITL)的分子特征差异,通过全外显子测序、RNA测序和DNA甲基化分析,揭示了二者在表观遗传调控(SETD2、H3-3A/B)、JAK-STAT通路(STAT5B/JAK3 vs STAT3/JAK1)和免疫微环境(HLA-I缺失、巨噬细胞浸润)的特异性改变,为精准诊断和靶向治疗提供重要依据。
 生物通微信公众号
生物通微信公众号
知名企业招聘