
-

生物通官微
陪你抓住生命科技
跳动的脉搏
外切酶融合CRISPR-Cas系统显著增强大豆靶向基因组编辑能力
【字体: 大 中 小 】 时间:2025年10月03日 来源:BMC Plant Biology 4.8
编辑推荐:
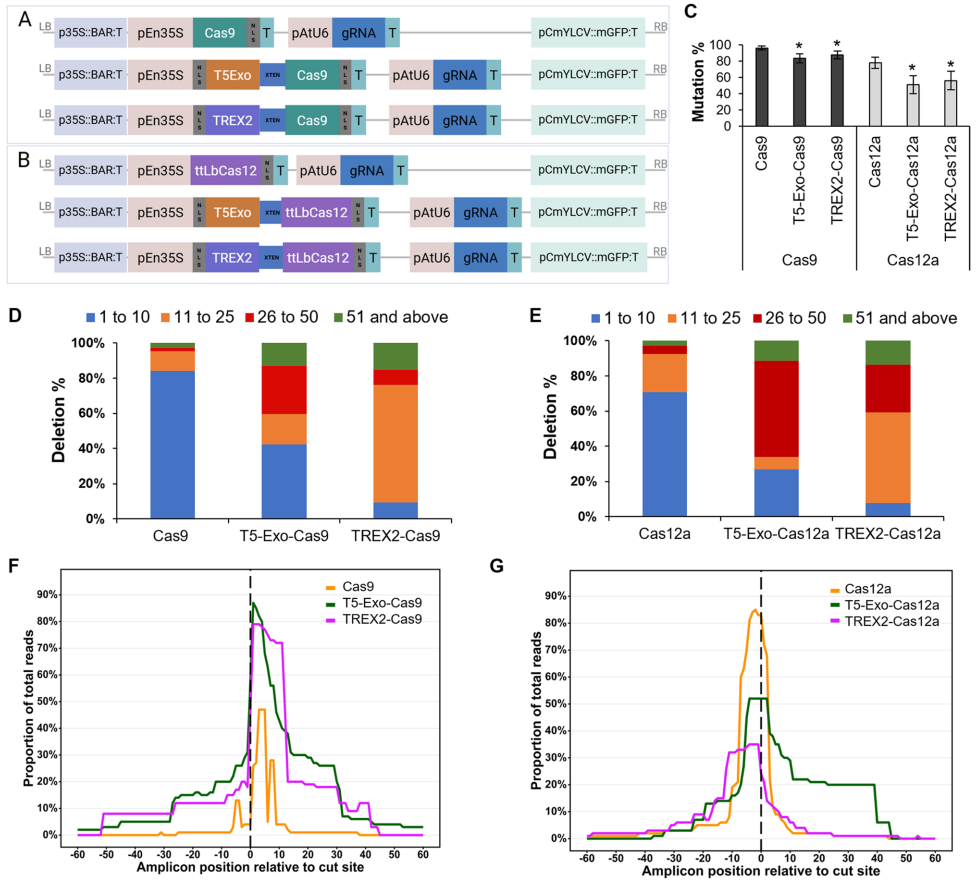
本研究针对CRISPR/Cas系统在大豆基因组编辑中主要产生小片段插入/缺失(indels)的局限性,创新性地将T5外切酶(5'-3'方向)和TREX2外切酶(3'-5'方向)分别与Cas9和Cas12a融合,通过发根农杆菌介导的转化和深度扩增子测序技术,系统评估了这些融合系统在GmWOX5位点的编辑性能。结果表明,外切酶融合显著提高了中等(26-50 bp)和大片段(>50 bp)缺失的频率,并减少了插入事件,为靶向顺式调控元件和microRNA等功能基因组学研究提供了高效工具。
 生物通微信公众号
生物通微信公众号
知名企业招聘