
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Arvelexin通过多靶点调控疼痛通路在雄性小鼠模型中展现显著镇痛效应
【字体: 大 中 小 】 时间:2025年10月02日 来源:Scientific Reports 3.9
编辑推荐:
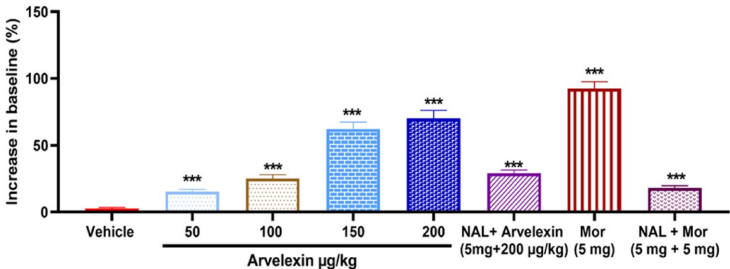
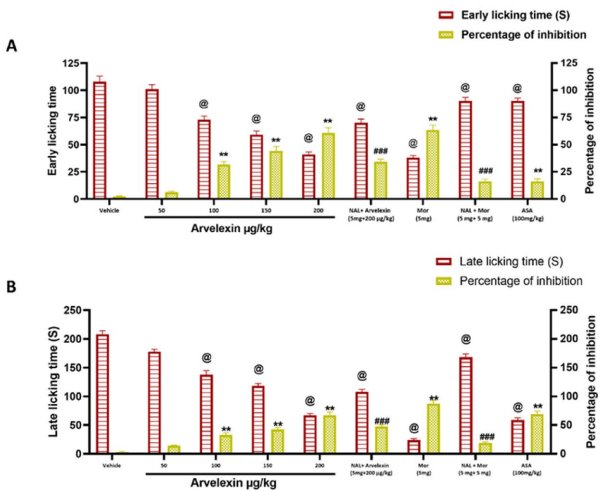
本研究针对传统镇痛药物存在胃肠道副作用和成瘾性等问题,探索了十字花科植物来源的天然化合物Arvelexin的镇痛潜力。通过多种疼痛模型(醋酸扭体、热板、福尔马林、辣椒素和谷氨酸诱导试验)证实其通过 opioid 系统、TRPV1 受体和谷氨酸能通路协同发挥中枢及外周镇痛作用,并显著降低促炎细胞因子(IL-1β、TNF-α、IFN-γ)水平,为开发新型多机制镇痛剂提供了实验依据。

 生物通微信公众号
生物通微信公众号
知名企业招聘