
-

生物通官微
陪你抓住生命科技
跳动的脉搏
约旦乳腺癌代谢重编程关键靶点GLUT-1与GLS2的表达特征及临床意义研究
【字体: 大 中 小 】 时间:2025年10月02日 来源:Scientific Reports 3.9
编辑推荐:
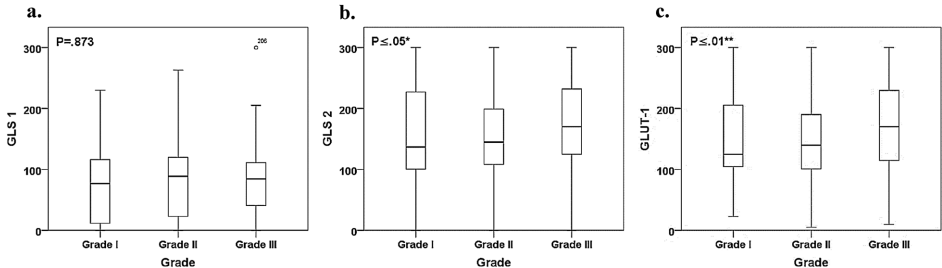
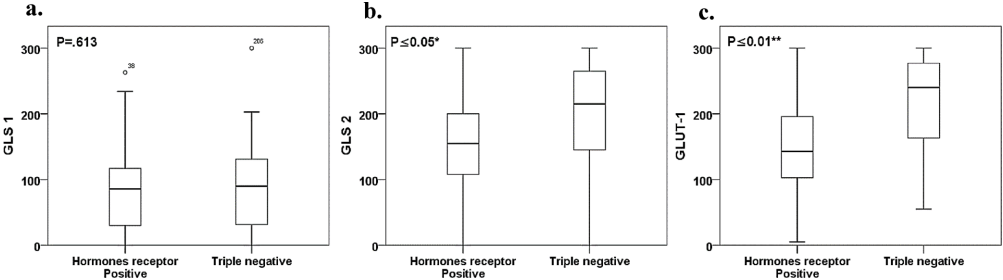
本研究针对乳腺癌代谢异质性,通过组织微阵列和免疫组化技术分析306例约旦患者样本中GLUT-1、GLS1和GLS2的表达模式。发现GLUT-1/GLS2在高级别肿瘤和三阴性乳腺癌中显著高表达,且与Ki-67增殖指数强相关,揭示了代谢适配在肿瘤进展中的关键作用,为地域特异性靶向治疗提供新依据。



 生物通微信公众号
生物通微信公众号
知名企业招聘