
-

生物通官微
陪你抓住生命科技
跳动的脉搏
多组学蛋白信号网络揭示肺腺癌性别特异性治疗靶点
【字体: 大 中 小 】 时间:2025年10月01日 来源:Biology of Sex Differences 5.1
编辑推荐:
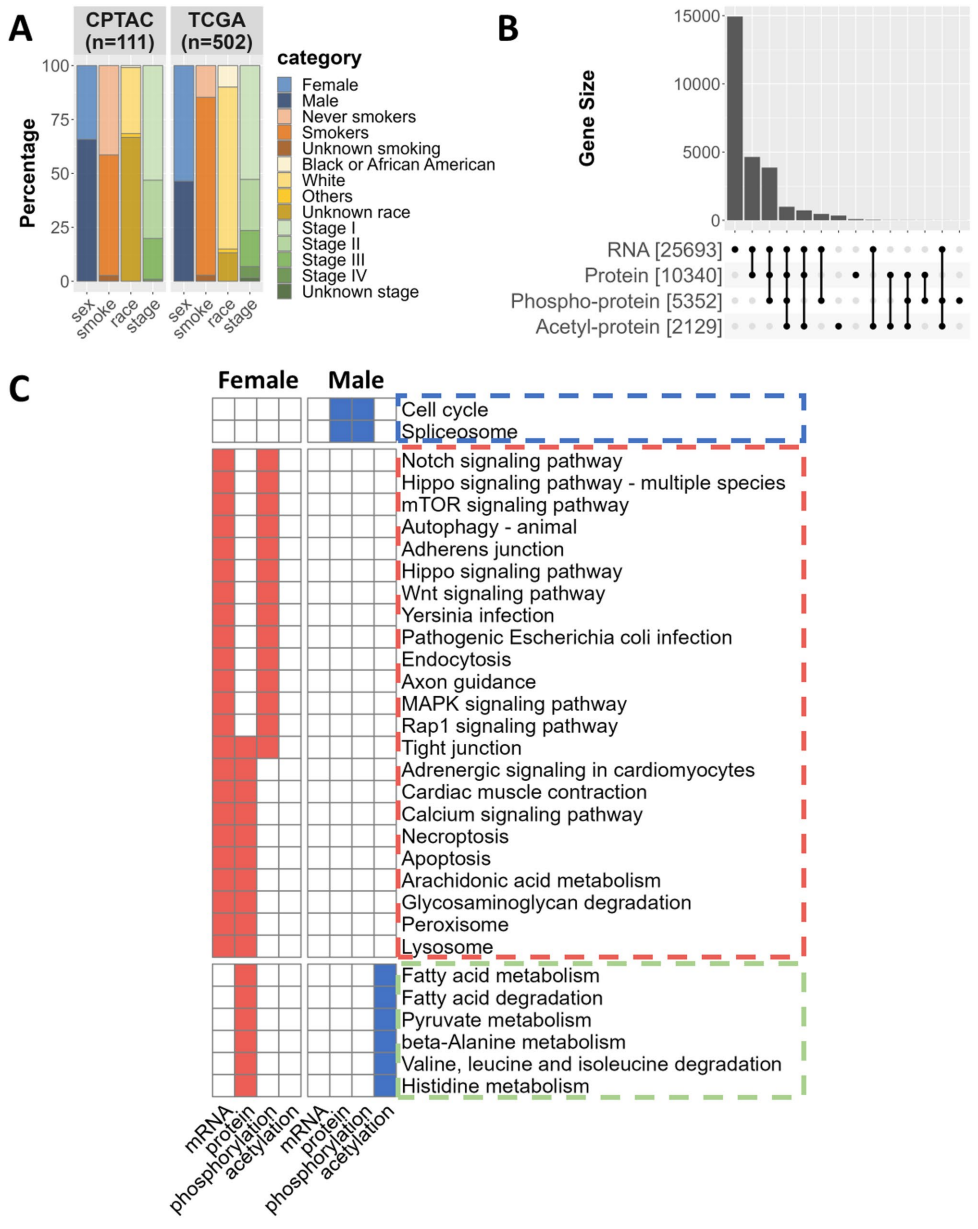
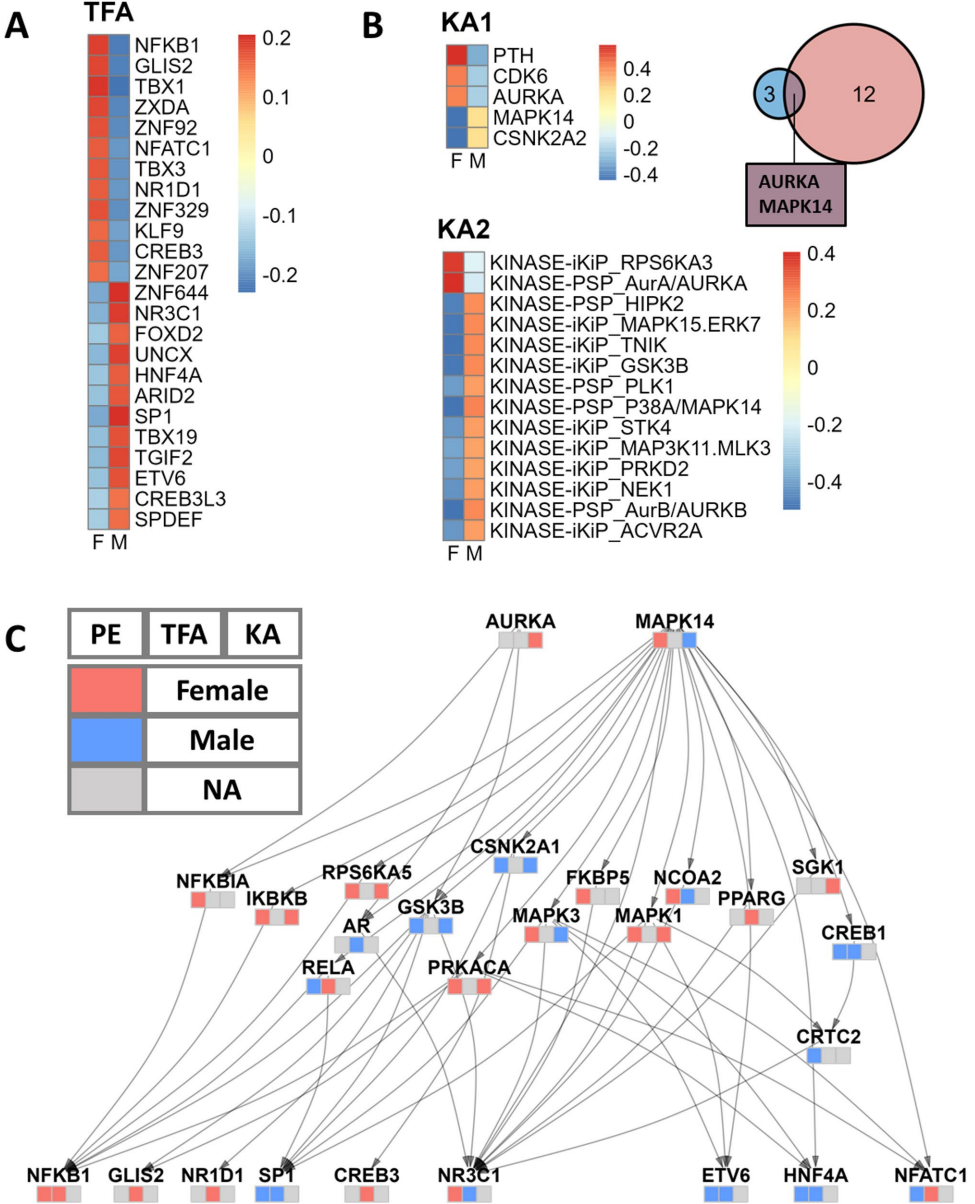
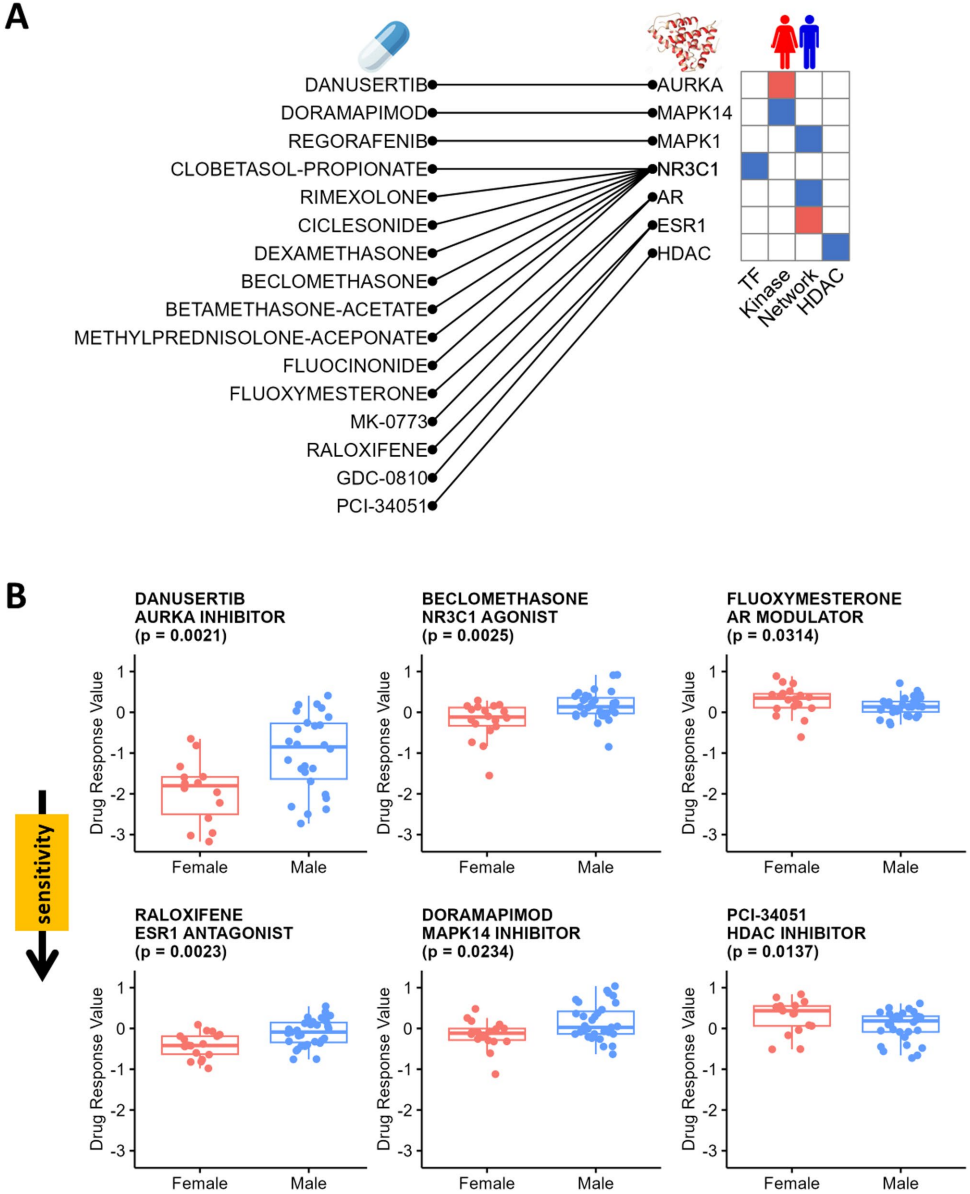
本研究针对肺腺癌(LUAD)中存在的显著性别差异,通过整合转录组与蛋白质组多组学数据,构建了性别特异性的激酶-转录因子信号网络。研究人员利用TCGA和CPTAC数据集,结合TIGER和PTM-SEA算法,发现NR3C1、AR、AURKA等关键分子存在性别偏向性表达和活性,并通过PRISM药物筛选平台鉴定出16种具有性别差异疗效的候选药物,包括糖皮质激素受体激动剂和极光激酶抑制剂。该研究为肺腺癌的性别个性化治疗提供了重要理论基础和临床转化方向。
 生物通微信公众号
生物通微信公众号
知名企业招聘